初三综合练习
B卷
班级_____ 姓名_____ 得分_____ 等第_____
一、选择题(每小题2分,共20分;每小题只有1个选项符合题意)
1.下列说法中错误的是 ( )
A.钢比生铁含碳量高 B.铁在氧气里燃烧生成四氧化三铁 1.A.
C.生铁和钢的主要成分都是铁 D.铁跟盐酸起反应生成氯化亚铁和氢气
2.下列化合物中,铁的质量分数最高的是 ( )
A.Fe3O4 B.Fe2O3 C.FeO D.FeS 2.C
3.下列反应中属于置换反应的是 ( )
A. CuO +2HCl ==== CuCl2+H2O 3.C
B.3Fe+2O2![]() Fe3O4
Fe3O4
C.Fe+CuSO4 ==== FeSO4+Cu
D.Fe2O3+3H2SO4 ==== Fe2(SO4)3+3H2O
4.向盛有少量氢氧化铜的试管中加入适量盐酸,充分反应后,再加入过量铁粉,反应完成后过滤,滤渣中含有的物质是 ( )
A.铜粉 B.铁粉 C.铜粉和铁粉 D.氢氧化铜和铁粉4.C
5.下列反应物到生成物的转化不能直接实现的是 ( )
A.Ba(NO3)2─→BaSO4 B.H2SO4─→HCl 5.C
C.CuO─→Cu(OH)2 D.Ba(OH)2─→Fe(OH)3
6.某盐R的式量为100,已知500克R恰和360克水结合形成结晶水合物R· nH2O,则n值是 ( )
A.2 B.3 C.4 D.5 6.C
7.5.6克某金属跟足量稀硫酸反应后,生成正二价金属化合物,同时放出0.2克氢气,这种金属是 ( )
A.Zn B.Fe C.Ca D.Mg 7.B
8.下列物质的用途利用了物质化学性质的是 ( )
A.活性炭除去冰箱异味 B.氧气可以供给呼吸 8.B
C.氢气用于充灌探空气球 D.干冰用于人工降雨
9.下列实验操作正确的是 ( )
A.过滤时,倾倒液体用玻璃棒引流 9.D
B.用剩的药品放回原瓶
C.用细口瓶盛放固体药品
D.用托盘天平称量药品时,左盘放砝码,右盘放药品
10.用镁和铝分别同稀硫酸反应,若要各制得10克氢气,则需要用去的镁和铝的质量比是 ( )
A.4∶3 B.8∶9 C.3∶1 D.1∶3 10.D
二、选择题(每小题2分,共30分;每小题有1~2个选项符合题意。若正确答案只包括一个选项,多选时该题为0分;若正确答案包括两个选项,只选一个且正确的给1分,选两个且都正确的给2分,但只要选错一个,该小题就为0分)
11.下列实验设计可行的是 ( )
A.将NaCl与NaNO3的混合物用溶解过滤法分离 11 BD
B.往铜盐溶液中加入铁粉以获得少量铜
C.将氢、氧混合气通入盛有灼热氧化铜的试管,可以除去氢气
D.用稀盐酸除去混在铜粉中的镁粉和铝粉
12.把质量相等,质量分数也相等的盐酸和苛性钠溶液混合,并滴入石蕊试液后溶液呈 ( )
A.红色 B.蓝色 C.紫色 D.无色 12 A
13.将一瓶稀盐酸分成4等份,分别跟适量的下列物质反应(恰好反应完全),所得氯化锌溶液的溶质质量分数最大的是加哪一份 ( )
A.锌 B.氧化锌 C.氢氧化锌 D.碳酸锌 13 A
14.不用其它试剂鉴别①Na2CO3、②KCl、③Ba(NO3)2、④CuSO4四种溶液,先直接鉴别出一种,再逐一鉴别出其余物质,则正确鉴别的顺序是 ( )
A.①④③② B.④①③② 14 BC
C.④③①② D.①③④②
15.某+2价金属的氯化物,经测定知道含氯55.9%,该金属元素是 ( )
A.Mg B.Ca C.Cu D.Fe 15 D
16.某金属元素R在氧化物里显+2价,其氧化物中R的质量分数为60%,则该氧化物的式量为 ( )
A.113 B.40 C.54 D.40克 16 B
17.a、b、c、d分别是HCl、BaCl2、AgNO3、Na2CO3四种物质的无色溶液中的某一种,现将它们两两混合,产生的现象如下表所示:
| 反应物 | a+b | c+d | c+b | a+c | b+d |
| 现象 | 白色沉淀 | 白色沉淀 | 无现象 | 白色沉淀 | 无色气体 |
由上可推知:a、b、c、d依次是 ( )
A.HCl、BaCl2、AgNO3、Na2CO3 B.AgNO3、HCl、Na2CO3、BaCl2 17 D
C.BaCl2、Na2CO3、HCl、AgNO3 D.AgNO3、HCl、BaCl2、Na2CO3
18.把CO和CO2的混和气体8克,通入澄清的石灰水中,最多可生成白色沉淀5克,则混和气体中CO和CO2质量比为 ( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]() 18 A
18 A
19.下列各组物质(最后一种都是过量的)加适量水溶解,搅拌过滤后,滤纸上留下两种不溶物质的是 ( )
A.CaCl2、Ca(NO3)2、Na2CO3 B.Al、Ag、CuSO4 19 BC
C.MgSO4、NaCl、Ba(OH)2 D.Cu(NO3)2、KCl、NaOH
20.根据质量守恒定律,2克氢气和20克氧气可以生成水 ( )
A.18克 B.22克 C.36克 D.无法确定 20 A
21.下列各组物质混和后,既不产生气体,也不产生沉淀,而且溶液质量减轻的
( )
A.锌和稀硫酸 B.盐酸和碳酸钠粉末 21 D
C.氯化钠溶液和硝酸银溶液 D.铜片插入硝酸汞溶液中
22.甲、乙两种物质是20℃时分别溶解在水里制成的饱和溶液。已知,12克甲溶液里含有甲物质2克;乙溶液中溶质的质量分数为20%。20℃,甲,乙两种物质的溶解度大小的关系是 ( )
A.甲>乙 B.甲<乙 22 B
C.甲=乙 D.无法确定
23.在硫酸铜的饱和溶液中,加入少量的硫酸铜粉末,出现的情况描述完全正确的一组是 ( )
①有蓝色的晶体析出 ②饱和溶液的溶剂量减少 ③饱和溶液的溶质量减少 ④饱和溶液的总质量增加 ⑤饱和溶液的总质量不变 23 C
A.① B.①②
C.①②③ D.①②③④
24.有A克10%的氯化钠溶液,现要使其浓度提高到20%,可以采用的方法是( )
A.蒸发掉溶剂的1/2 B.蒸发掉A/2克溶剂 24 B
C.蒸发掉溶剂的10% D.加入0.1A克氯化钠
25.下列括号内的气体是需要检验的杂质,其中检验方法合理的是 ( )
A.H2、CO2(CO)![]()
![]() 25 B
25 B
B.H2、(CO2、HCl)![]()
![]()
C.CO2(CO)![]()
![]()
D.CO(H2O、CO2)![]()
三、填充题(共16分)
26.(3分)某含氧酸的化学式是HnROn+2,其式量为M,用代数式表示R的化合价为___________,R的原子量为___________,当n=2时,R的化合价为____________。
26 +(n+4); M-17n-32; +6
27.(4分)26.6硝酸钠溶于114克水中所得溶液均匀分成三等份。
(1) 每1份溶液中溶质的质量分数为______。
(2) 将一份溶液加入10克水后,所得溶液中溶质的质量分数为________。
(3) 将一份溶液再溶解10克硝酸钠,所得溶液中溶质的质量分数为________。
(4) 再将一份溶液稀释为原溶质质量分数的一半,应加水的体积为_______毫升。
27 ⑴18.6%; 19% ⑵17.7% ⑶24.3% ⑷ 70.3
28.(3分)当CO和CO2的分子个数比为2∶3时,它们的质量比___________,它们所含的氧元素的质量比是______________________,氧原子的个数比是_____________________。
28 14︰33; 1︰3; 1︰3
29.(2分)今有化学反应:4XY2+Y2==2Z,则生成物Z的化学式可以用x、y表示为________ 。 29 X2Y5
30.(4分)从铁、水、氧化钙、盐酸、石灰水、碳酸钠溶液和石灰石等物质中选择反应物(每种物质只能选用一次),按下面的要求各写一个化学方程式:
⑴化合反应________________________
⑵分解反应________________________
⑶置换反应____________________________
⑷复分解反应________________________________
30.⑴CaO+H2O=Ca(OH)2 ⑵CaCO3![]() CaO+CO2↑ ⑶Fe+2HCl==== FeCl2+H2↑
⑷Na2CO3+Ca(OH)2====CaCO2↓+2NaOH
CaO+CO2↑ ⑶Fe+2HCl==== FeCl2+H2↑
⑷Na2CO3+Ca(OH)2====CaCO2↓+2NaOH
四、实验题(共14分)
31.(10分)(1)用下列所提供的仪器装配成一套“一氧化碳(干燥的)与氧化铜反应”的实验装置,从左到右的顺序是(用代号填写)________________。
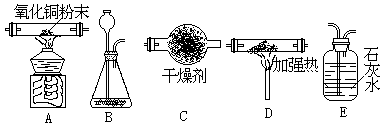 |
(2)D中应放的物质是__________________,B中应放的物质是________________。
(3)A中氧化铜是________剂。
(4)最后尾气应作如何处理________________________________
(5)写出有关化学方程式:
A中:___________________、
B中:___________________、
D中:___________________、
E中:___________________。
31. (1)B; D; C;
A; E
(2)炭粉;大理石、稀盐酸 (3)氧化 (4)用酒精灯将尾气点燃(或用气球收集后统一处理)。 ⑸:CO+CuO ![]() CO2+Cu; CaCO3+2HCl ===CaCl2 +CO2↑+H2O; CO2+C
CO2+Cu; CaCO3+2HCl ===CaCl2 +CO2↑+H2O; CO2+C![]() 2CO; Ca(OH)2+CO2===CaCO3↓+H2O;
2CO; Ca(OH)2+CO2===CaCO3↓+H2O;
32.(4分)氢氧化钠固体暴露在空气中,观察到的现象是______________________,这现象叫______________。在空气中久置一段时间,能生成白色粉末物质,此物质主要含有____________,用化学方程式表示发生的变化:______________________________。
若向白色粉末物质滴加盐酸时,现象是______________________________,化学方程式为_______________________________________________。
32. 固体表面逐渐形成溶液;潮解; Na2CO3 ;;CO2+2NaOH====Na2CO3+H2O;有无色气体析出;Na2CO3+2HCl==== 2NaCl+H2O+CO2↑
五、推断题(10分)
33.(5分)A、B、C、D、E分别是常见的酸、碱、盐中的某种物质,并且已知A是含钠元素的化合物。它们之间有如下关系: 2A+B=C+2H2O (2) C+D=BaSO4↓+2A (3) D+CuSO4=BaSO4↓+E↓;根据以上反应,推断各物质的化学式:
A____________;B____________;C____________;D____________;E________。
33. NaOH;H2SO4;Na2SO4 ;Ba(OH)2 ;Cu(OH)2
34.(5分)为了制取氧气,取一定量的氯酸钾和二氧化锰的混和物,二氧化锰在混和物中的质量分数为20%,加热后,二氧化锰质量分数提高到25%,则此时氯酸钾分解的百分率是____________。
34.63.8%
六、计算题(共10分)
35.(5分)t℃时,向100克质量分数为20%的氢氧化钠溶液中加入等质量的硫酸溶液,恰好完全反应,并测得反应后溶液的pH等于7,然后蒸发掉39.5克水,再冷却到t℃,恰好成为饱和溶液。求:(1)硫酸溶液中溶质的质量分数。(2)t℃时生成物的溶解度。
35.⑴24.5% ⑵28.4克
36.(5分)含碳酸钙90%的石灰石50克和100克盐酸恰好完全反应(杂质不反应也不溶于水),可得多少升二氧化碳?同时生成的氯化钙溶液的质量分数是多少?(标准状况下二氧化碳的密度为1.98克/升)
36. 10升; 15.8%