化学模拟试题(十六)
学校 班级 姓名
| 题 号 | | | | | | |
| 得 分 | | | | | | |
原子量:H—1 S—32 O—16 P—31 Cu—64 C—12 Mg—24
Na—23 Cl—35.5 Ag—108 N—14
一、 选择题(每题只有一个正确答案)(25%)
1.下列变化中,前者是物理变化,后者是化学变化的一组是( )
① 盐酸除锈、石蜡熔化。②白磷自燃,空气液化。③三氧化硫溶于水,二氧化碳通入石灰水。④白色硫酸铜粉末通水变蓝,酸、碱溶液使指示剂变色。⑤冰融化成水,倒置泡沫灭火器产生二氧化碳。⑥汽油挥发、酒精燃烧。
A.①③ B.②⑥ C.④⑤ D.⑤⑥
2.下列物质中,前一种属于单质,后一种属于混合物的是( )
A.生铁、水 B.天然气、石墨
C.液氧、碘酒 D.硫、胆矾
3.下列叙述中,正确的是( )
A.物质都是由分子构成的
B.水分子是保持水的化学性质的最小微粒
C.原子在化学变化中可以再分
D.原子核是由质子和电子构成的
4.能使无色的酚酞试液变成红色的物质是( )
A.水 B.硗碱溶液
C.稀硫酸 D.食盐水
5.下列说法中,正确的是( )
A.浓溶液不一定是饱和溶液,稀溶液也不一定是不饱和溶液
B.温度升高时,物质的溶解度都增大
C.凡是均一、透明的液体就是溶液
D.200C时,氯化钠的溶解度是36克,它的饱和溶液中溶质的质量分数是36%
6.下列物质中,氮元素的化合价最低的是( )
A.HNO3 B.N2 C.NH3 D.NO2
7.下列各种物质的用途中,利用了有关物质的化学性质的是( )
A.氢气用于填充探空气球
B.一氧化碳用于冶炼金属
C.干冰用于人工降雨
D.大理石加工成装饰品
8.下列各式中,正确的是( )
A.Ba(OH)2===Ba2++(OH—)2
![]() B.H2SO4===H2++SO4—2
B.H2SO4===H2++SO4—2
C.2Fe+6HCl===2FeCl3+3H2
D.2NaOH+SO3===Na2SO4+H2O
9.氢元素的质量分数相同的一组物质是( )
A.H2SO4和H3PO4 B.H2SO4和Cu(OH)2
C.H2O和H2S D.C2H5OH和CH3COOH
10.对于有单质和化合物生成的反应,下列说法中正确的是( )
A.不可能是分解反应 B.一定是转换反应
C.一定不是复分解反应 D.可能是化合反应
11.下列各组物质能发生置换反应的是( )
A.Cu和稀H2SO4 B.Zn和AgCl
C.Al和CuCl2溶液 D.Hg和CuCl2溶液
12.下列各项中括号里的物质是除去杂质所用的药品,其中错误的是( )
A.NaOH中混有Na2CO3(盐酸)
B.CO中混有CO2(石灰水)
C.H2中混有HCl(NaOH溶液)
D.KNO3溶液中混有KCl(AgNO3溶液)
13.有甲、乙两种物质,它们分别由A、B两种元素的一种或两种组成。已知2个甲分子跟1个乙分子化合成2个丙分子。乙的化学式为B2,丙的化学式为AB3,则甲的化学式为( )
A.AB2 B.A2B C.AB3 D.AB
14.铁粉中混有少量氧化铜杂质,把这种铁粉放到一定量的稀硫酸中,充分反应后,发现容器底部尚有铁粉剩余,则存在于溶液里的金属阳离子( )
A.肯定是Cu2+和Fe2+
B.肯定是Cu2+,可能有Fe2+
C.肯定是Fe2+,可能有Cu2+
D.肯定是Fe2+,没有Cu2+
15.下列物质中,既能和水反应,又能分别与铁、氯化钡、烧碱在水中反应的是( )
A.碳酸钾 B.盐酸 C.硝酸镁 D.无水硫酸铜
16.下列实验操作中,不正确的是( )
![]() A.使用酒精灯前,先向灯里添满酒精
A.使用酒精灯前,先向灯里添满酒精
B.给试管里的液体加热,液体体积不超过试管容积的
C.稀释浓硫酸时,把浓硫酸沿器壁慢慢注入盛水的烧杯中
D.用漏斗过滤时,液面低于滤纸的边缘
17.下列物质存放在烧杯中,一段时间后,质量变大且变质的是( )
①浓盐酸 ②浓硫酸 ③烧碱 ④纯碱 ⑤生石灰 ⑥食盐
A.①⑥ B.②③④⑤ C.②③④ D. ③⑤
![]()
![]() 18.有食盐水a克,其溶质的质量分数为m%,若将其质量分数稀释到n%,应加水的质量是( )
18.有食盐水a克,其溶质的质量分数为m%,若将其质量分数稀释到n%,应加水的质量是( )
A. B.
![]()
![]() C.
D.
C.
D.
19.t0C时的硝酸钾溶液200克,蒸发20克水后,析出晶体8克,又蒸发20克水后析出12克,则t0C时硝酸钾的溶解度( )
A.60克 B.50克 C.40克 D.100克
20.下列说法错误的是( )
![]() A.原子量的国际单位制单位为克
A.原子量的国际单位制单位为克
B.结构为 的微粒属于同种元素
C.“2Fe2+”表示2个铁离子
D.氧化物中一定含有氧元素
21.甲、乙、丙、丁四种溶液,各是AgNO3、KCl、HNO3、K2CO3溶液中的一种。乙、丙混合时产生的沉淀不溶于甲,而乙、丁混合时产生的沉淀能溶于甲,则甲、乙、丙、丁四种溶液依次为( )
A.KCl、K2CO3、AgNO3、HNO3
B.HNO3、KCl、AgNO3、K2CO3
C.HNO3、AgNO3、K2CO3、KCl
D.HNO3、AgNO3、KCl、K2CO3
22.5.6克下列各组混合物与足量盐酸反应,有可能生成0.2克氢气的一组混合物是( )
A.铁和铜 B.镁和铜
C.锌和铜 D.镁和铝
23.将溶质质量分数为10%的氢氧化钠溶液40克,与溶质质量分数为10%的盐酸溶液36.5克充分反应,常温下反应后溶液的pH值( )
A.大于7 B.小于7 C.等于7 D.无法确定
24.计算结果或计算式正确的是( )
A.CuSO4·5H2O的式量:64+32+16×4×5(1×2+16)
B.80克CuO中含铜元素64克
C.2HgO的式量总和:2×201+16=418
D.Ca(OH)2的式量:40+16+1×2=58
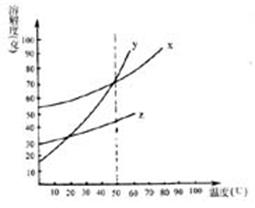 25.x、y、z三种物质的溶解度曲线如右图所示,下列说法中,不正确的是( )
25.x、y、z三种物质的溶解度曲线如右图所示,下列说法中,不正确的是( )
A.溶解度x>y>z
B.500C时,x、y的饱和溶液中溶质的质量分数相同
C.当y中含有少量z时,可通过降温结晶提纯y
D.x、y、z都属于易溶于水的物质
二、填空题(48.5%)
1.用元素符号或化学式表示:
(1)地壳中含量最多的元素 ;(2)空气中含量最多的气体是 (1%)
2.有H2、O2、CO、CO2、CH4五种气体,能溶于水且水溶液能使石蕊试液变红色的是 ,能使氧化铜还原成铜的气体化合物是 ,属于有机物的是 ,能与灼热炭发生反应的是 。(2.5%)
3.从C、H、O、Cu四种元素中,选择适当的元素组成物质,按下列要求写出各物质的化学式。(4%)
(1)碱 (2)含氧酸 (3)碱性氧化物 (4)碱式盐
4.民族英雄林则徐利用生石灰与水反应的产物及放出的热来销毁鸦片。写出生石灰与水反应的化学方程式 ,此反应的产物俗称 ,常用于改良 性土壤。(3%)
5.200C时,把m克某物质溶于水,制得V毫升,密度为P克/厘米3的饱和溶液,则200C时该物质的溶解度为 。(2%)
6.工业上用电解食盐水的方法制取氢氧化钠,同时产生氢气和氯气,该反应的化学方程式是: (2%)
7.在治疗胃酸(含盐酸)过多时,常服用含氢氧化铝的药物,它起 作用。化学方程式为 属于 反应(类型)。(3%)
8.将氯酸钾和高锰酸钾的混合物加热制取氧气,先反应的物质名称是 ,
该反应的化学方程式为 ,后反应的物质的反应方程式是 。(4.5%)
9.将一根铜丝在酒精灯上加热使其表面变黑,化学方程式为 ,
然后,将其浸入盛有稀H2SO4的试管中,充分反应后,溶液变为 色,化学方程式为 。最后将该铜丝浸入Hg(NO3)2溶液中,过一会儿,可观察到铜丝表面附着一层 色物质,化学方程式为
。(7%)
10.从玻璃棒、漏斗、100毫升量筒,胶头滴管,试管夹、10毫升量筒,铁架台,药匙等仪器中,选取合适的仪器填入下列横线上:(2%)
(1)取用粉末状药品要用 ;
(2)量取5毫升液体用 ;
(3)给试管里的物质加热,必须使用 。
11.8克三氧化硫和42克水相混合,搅拌,所得溶液中溶质的名称是 ,
溶液的pH值 7(填“>”“=”“<”),该溶液能使紫色石蕊试液变 色;溶液中溶质的质量分数为 %,若向溶液中加入 克水,溶液中溶质的质量分数降低一半。(3.5%)
12.白磷通常要保存在水里,因为它的着火点很低,在空气里容易因 而引起自燃,生成 色固体,此反应的化学方程式是
(4%)
13.一瓶氢氧化钠溶液因长期在空气里敞口放置而变质,写出氢氧化钠变质的化学方程式 。取少量变质后的溶液于试管中,加入稀硫酸有气泡生成,写出该反应的化学方程式 。(4%)
14.已知某固体粉末是NaCl、BaCl2、CuSO4、Na2SO4之一或几种的混合物,做以下实验:
(1)粉末加水,振荡后呈浑浊,过滤,滤液无色;当向溶液中加入AgNO3溶液时,产生白色沉淀,继续加入足量的稀HNO3,沉淀不消失。
(2)将滤出的沉淀加足量的稀HCl时,沉淀不消失,原粉末中一定有 一定不含有 ,可能含有 。(4%)
15.欲除去盐酸中混有的少量硫酸,应加入适量(填名称) 溶液,并进行 ,该反应的化学方程式为 。(3%)
三、实验题:(11%)
1.实验室里,用氯化铵晶体跟氢氧化钙粉末混合加热制取氨气。它是一种无色的,有刺激性气味的,密度比空气小,而溶于水且能跟水反应生成氨水的气体,制取氨气过程中还有氯化钙和水生成。
(1)写出制取氨气的化学方程式: (2%)
(2)实验室制取(不包括收集)氨气的装置,可选用制取 (H2或O2或CO2)的装置。其理由是 。收集氨气可用 法。(2%)
2.为了制取干燥的CO2并进行有关实验,采用下列实验装置,请回答以下问题:(7%)
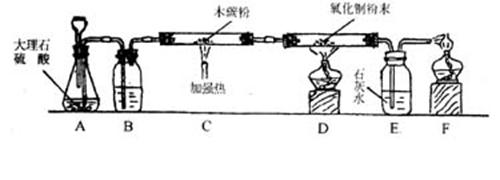 |
(1)作为CO2发生器的装置A中有 处错误,经改正后,该装置中发生的反应的化学方程式为 。(3%)
(2)装置B中装的物质通常是 。(0.5%)
(3)装置C中发生的化学方程式为 。(2%)
(4)装置D在实验中,观察到的主要现象是 。(0.5%)
(5)装置E的作用是 。(0.5%)
(6)装置F中为何要将尾气点燃?
。(0.5%)
四、计算题:(15.5%)
1.不纯的镁粉3克,放入盛有50克稀硫酸的烧杯中,恰好完全反应,测知烧杯中物质质量减少了0.2克。(杂质不溶于稀硫酸)试求:
(1)镁粉中含杂质的质量分数。(3%)
(2)稀硫酸溶液的质量分数。(3%)
2.有一种由氯化钠和硝酸钠组成的固体混合物12.35克,加入27克水溶解,滴入硝酸银溶液75克,恰好完全反应,生成氯化银沉淀14.35克。取反应后滤液40克,蒸发去26.5克水,冷却到100C,溶液恰好饱和,计算:(9.5%)
(1)根据质量守恒定律,反应后滤液的质量为 克。(0.5%)
(2)混合物中,氯化钠的质量。(3%)
(3)反应后滤液中溶质的质量分数。(3%)
(4)100C时硝酸钠的溶解度。(3%)
参考答案:
一、选择题:
1.D 2.C 3.B 4.B 5.A 6.C 7.B 8.D 9.B 10.C 11.C 12.A 13.A 14.D 15.D 16.A 17.D 18.B 19.A 20.C 21.D
22.B 23.C 24.B 25.A
二、填空题:
1.(1)O;(2)N2
2.CO2;CO;CH4;O2、CO2
3.(1)Cu(OH)2;(2)H2CO3 ;(3)CuO;(4)Cu2(OH)2CO3
4.CaO+H2O===Ca(OH)2;熟石灰(消石灰);酸
![]()
|
![]()
![]() 6.2NaCl+2H2O====2NaOH+H2 +Cl2
6.2NaCl+2H2O====2NaOH+H2 +Cl2
|
![]()
|
|
10.(1)药匙;(2)10毫升量筒、胶头滴管;(3)试管夹。
|
12.缓慢氧化;白;4P+5O2====2P2O5
13.2NaOH+CO2====Na2CO3+H2O;
![]() Na2CO3+H2SO4====Na2SO4+CO2 +H2O
Na2CO3+H2SO4====Na2SO4+CO2 +H2O
14.Na2SO4和BaCl2;CuSO4;NaCl
![]() 15.氯化钡;过滤;H2SO4+BaCl2====BaSO4 +2HCl
15.氯化钡;过滤;H2SO4+BaCl2====BaSO4 +2HCl
|
![]() 1.(1)2NH4Cl+Ca(OH)2====CaCl2+2NH3 +2H2O
1.(1)2NH4Cl+Ca(OH)2====CaCl2+2NH3 +2H2O
(2)O2;两种反应物均为固体,且反应需加热;向下排空气
![]() 2.(1)3;CaCO3+2HCl====CaCl2+CO2 +H2O
2.(1)3;CaCO3+2HCl====CaCl2+CO2 +H2O
|
(3)CO2+C===2CO
(4)黑色粉末变红色
(5)吸收CO2气体
(6)防止反应过程中产生的过量CO排放到空气中造成污染
四、计算题:
1.(1)20% (2)19.6%
2.(1)100 (2)5.85克 (3)15% (4)80克