常州市二○○五年初中毕业、升学统一考试化学试题
说明:1.本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,第Ⅰ卷1至2页,第Ⅱ卷3至6页。考试结束,将本试卷和答题卡一并交回。
2.试卷满分为100分。考试时间为100分钟。考试时允许使用CZl206、HY82型函数计算器。
3.可能用到的相对原子质量:Ar(Na)=23 Ar(Mg)=24 Ar(Al)=27 Ar(Fe)=56
Ar(Zn)=65 At(H)=1 Ar(N)=14 Ar(O)=16 At(S)=32
第Ⅰ卷(选择题 共40分)
注意事项:
1.答第Ⅰ卷前,考生务必将自己的姓名、考试证号、考试科目用2B铅笔涂写在答题卡上。
2.每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其他答案,不能答在试题卷上。
一、选择题(本题包括20小题,共40分。每小题只有一个选项符合题意)
1.我们每天都和化学变化打交道,以下叙述中没有发生化学变化的是
A.吃进的食物一段时间被消化了 B.课外体育活动时,呼吸作用增强
C.水放进冰箱一段时间后结成冰 D.人体吸收氨基酸后,结合成所需的各种蛋白质
2.下列物质中属于有机物的是
A.干冰 B.蒸馏水 C.小苏打 D.酒精
3.现有H2S、S、M、SO3四种物质,是按硫元素的化台价由低到高排列的,其中M这种物质的化学式可以是
A.H2SO3 B.H2SO4 C.Na2S D.Na2SO4
4.下列选项中物质的名称、俗名、化学式一致的是
A.二氧化碳 冰 CO2 B.氢氧化钙 熟石灰 Ca(OH)2
C.氧化钙 石灰石 CaO D.氧气 臭氧 O3
5.下列物品中富含蛋白质的是
A.大白菜 B.鸡蛋 C.大米 D.植物油
6.几种作物适宜生长的pH范围如下:水稻6.0~7.0、棉花6.0~6.8、甘蔗6.0~8.0、烟草5.0~6.0、茶树5.0~5.5。取某地土壤浸出液加几滴紫色石蕊试液,溶液略显蓝色。则这种土壤适宜种植的作物是
A.水稻 B.棉花 C.甘蔗 D.茶树
7.下列说法中不正确的是
A.任何物质都可以燃烧 B.铁在潮湿的空气中易生锈
C.回收废金属可减少对环境的污染 D.煤、石油和天然气都是重要的化工原料
8.下列关于水的说法不正确的是
A.水是生命活动不可缺少的物质 B.水是常见的溶剂
C.水既可作为反应物,也可以是生成物 D.水是由氢气和氧气组成的一种氧化物
9.下列说法中不正确的是
A.聚氯乙烯薄膜不宜用于包装食品 B.淀粉溶液遇碘呈现蓝色
C.工业酒精含有甲醇,不能用于勾兑饮用酒 D.吸烟使人精神振奋,有益健康
10.在一定条件下,下列物质间的转化不能一步实现的是
A.KMnO4→MnO2 B.CO→H2CO3
C.Cu(OH)2→Cu2O D.S→SO2
11.下列仪器中,能用酒精灯火焰直接加热的有
①试管 ②集气瓶 ③瓷质蒸发皿 ④量筒 ⑤烧杯 ⑥燃烧匙 ⑦石棉网
A.①③⑥⑦ B.①②⑤⑦ C.①④⑤⑥ D.②③⑤⑥
12.下列关于氢氧化钠的叙述不正确的是
A.固体氢氧化钠要密闭保存
B.氢氧化钠溶液与稀硫酸反应时没有热量变化
C.固体氢氧化钠可作一些气体的干燥剂
D.氢氧化钠溶液对皮肤、纸张、织物有强腐蚀性
13.下列有关实验现象的描述不正确的是
A.棉花在酒精灯的火焰上灼烧后会产生烧焦羽毛味
B.纯净的氢气在空气中点燃产生淡蓝色火焰
C.铁丝在氧气中燃烧火星四射,放出大量的热,同时生成黑色固体
D.在试管中加热铜绿有黑色固体生成,同时有气体和水珠生成
14.酸和碱的组成中一定含有的元素是
A.氧元素 B.氢元素 C.氮元素 D.金属元素
15.在①单质、②氧化物、③酸、④碱等四类物质中,经一步反应可以生成盐的是
A.只有①②③ B.只有②③④ C.只有①②④ D.①②③④
16.下列有关溶液的叙述正确的是
A.饱和溶液中溶质的质量一定大于不饱和溶液中溶质的质量
B.向水中加入少量稀硫酸可增强溶液的导电性
C.少量的固体物质溶于水形成的稀溶液的沸点比水低
D.蒸发溶剂能析出溶质的原溶液一定是饱和溶液
17.常温下,下列各组物质中相互间能发生化学反应的是
A.碳和氧气 B.铜和硫酸锌溶液 C.铝和氧气 D.氧化铜和水
18.20℃时,氯化钠的溶解度是36g,下列说法中正确的是
A.20℃时,该溶液的溶质质量分数为36%
B.20℃时,100g饱和溶液中含氯化钠36g
C.20℃时,100g水中最多能溶解氯化钠36g
D.20℃时,饱和氯化钠溶液不能再溶解其他物质
19.市场上有所谓的健康低钠盐出售,下列有关低钠盐的叙述合理的是
A.低钠盐含有少量的金属钠单质,故称低钠盐
B.低钠盐中的钠离子比氯离子少。所以低钠盐是一种带电物体
C.低钠盐是指没有提纯的粗盐,其中含有大量不溶物
D.低钠盐中含有钾离子,所以比相同质量的氯化钠含较少的钠离子
20.锌粉、铝粉、铁粉、镁粉的混合物3.8g与一定质量溶质质量分数为25%的稀硫酸恰好完全反应,将反应后的混合物蒸发水份得固体(不含结晶水)11g,则反应中生成氢气的质量为
A.0.15g B.0.20g C.0.30g D.0.45g
第Ⅱ卷(非选择题 共60分)
二、(本题包括3小题,共20分)
21.(10分)按要求写出下列反应的化学方程式:
(1)向双氧水中加入少量二氧化锰_____________________________________________。
(2)锌粒与盐酸反应_________________________________________________________。
(3)硫酸与氢氧化钠反应_____________________________________________________。
(4)葡萄糖(C6H12O6)在人体内缓慢氧化______________________________________。
上述反应中,属于分解反应的是________,属于置换反应的是________。(填序号)
22.(5分)在甲醛、陶瓷、橡胶、碳酸氢铵、乙醇、熟石灰、大理石、硝酸钾等八种物质中,常用来改良酸性土壤的是__________,常用作浸制动物标本的是__________,在农业上作为铵态氮肥的是__________,可以代替汽油用作汽车燃料的是__________,属于无机非金属材料的是__________。(每空选填一种物质的名称)
23.(5分)请从提供的试剂中,选择一种以除去下列物质中的少量杂质(括号内为杂质)。把试剂的序号填在相应的横线上(试剂不能重复使用)。
供选用的试剂:①浓硫酸 ②水 ③稀硝酸 ④盐酸 ⑤氢氧化钠溶液
(1)Cu粉(Fe)________(2)CaCO3粉末(CaCl2)________(3)CO(CO2)________
(4)O2(H2O蒸气)________ (5)KNO3溶液(K2CO3) ________
三、(本题包括2小题。共10分)
24.(3分)下列各项化学实验的操作中,正确的是______________(填序号)。
A.过滤时,将待过滤的混合物直接倒人漏斗中
B.被加热的玻璃容器外壁如有水,加热前应擦干
C.熄灭酒精灯只能用灯帽盖灭,不能用嘴吹、手扇等方法熄灭
D.用托盘天平称量物质时,先加小砝码再依次加较大的砝码
E.实验室用加热高锰酸钾的方法制氧气时,试管口应略向下倾斜
25.(7分)我国青海湖地区素有“夏天晒盐,冬天捞碱”之说,其中捞出的碱主要是碳酸钠和少量氯化钠的混合物。小王同学以捞出的碱作为样品,并用以下一套装置对样品进行分析,根据量筒中收集到的液体的体积(相当于二氧化碳的体积)来计算样品中碳酸钠的含量。(已知:HCl+NaHCO3===NaCl+CO2↑+H2O;CO2在饱和NaHCO3溶液中溶解度很小)
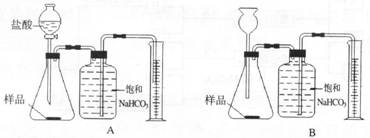
(1)在A和B 两套装置中,哪一套装置更合理________(选填“A”或“B”)。
(2)准确读取量筒内液体体积的方法是__________________________________________
________________________________________________________________________。
(3)锥形瓶中原有的空气对实验结果是否有明显影响? ______(填“有”或“没有”)。
(4)若实验中用的盐酸是浓盐酸,则测得的样品中碳酸钠的含量与实际值相比会________
(填“偏大”或“偏小”或“不变”)。
(5)在实验过程中,对取用样品的量的多少有一定要求,为什么?___________________
_____________________________________________________________________________
________________________________________________________。
四、(本题包括2小题,共12分)
26.(6分)已知在溶液中氢氧化钙和碳酸钠反应生成碳酸钙和氢氧化钠。现实验室中有一包白色粉末,可能是碳酸钠,也可能是氧化钙或氢氧化钙。为确定其组成,某同学设计了以下实验方案进行探究,请你按要求帮助完成探究活动。
(1)提出假设:假设① 白色粉末是碳酸钠
假设② 白色粉末是氧化钙
假设③ 白色粉末是氢氧化钙
(2)设计实验,通过实验分析进行判断并填空:
| 假设 | 设计的相关实验操作 | 实验中观察到的现象 | 假设是否成立 |
| ① | 取一定量粉末加入稀盐酸 | 没有气体产生 | _______________ |
| ② | 取一定量粉末溶于水 | 溶液浑浊且温度升高 | _______________ |
| ③ | 取一定量粉末溶于水,静置后取上层清液再通人二氧化碳 | 没有沉淀产生 | _______________ |
(3)实验后思考:假定这包白色粉末是混有少量氧化钙的碳酸钠粉末,将混合物溶于水可观察到的现象是___________________________________________________;若将反应后的混合物进行固液分离,分离的方法是_______________;再将分离后的溶液蒸干,得到的固体物质是________________________(填化学式)。
27.(6分)以下是一些常见物质间互相转化的关系图(有些反应条件已省略):
已知高温下CO能与多种金属氧化物反应生成相应的金属和CO2。下列关系图中,A、B、X、Y均为无色气体,E、F为常见金属。
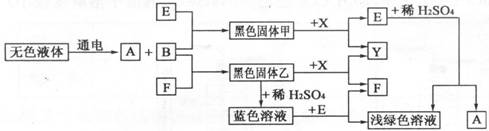
问:(1)根据上图判断B的化学式为________________;Y的化学式为________________。
(2)写出蓝色溶液与E反应的化学方程式_____________________________________。
(3)X除了与黑色固体甲、乙反应外,请再举一例说明X还能发生化合反应,写出反应的化学方程式_______________________________________________________。
五、(本题包括2小题,共10分)
28.(4分)现有500mL溶质质量分数为l0%的氯化钾溶液(密度约为1.1g/mL)。问:
(1)溶液中含氯化钾多少克?
(2)向上述溶液中加入等体积的水后(水的密度为1.0g/mL),溶液的溶质质量分数变为多少?(计算结果请用百分数表示且保留一位小数)
29.(6分)镁条在空气中易被氧化,有一根在空气中放置一段时间的镁条样品,其质量为2.56g,把该样品与足量的稀硫酸反应得到氢气0.18g。问:
(1)样品中未被氧化的镁的质量是多少?
(2)该镁条未被氧化时的质量是多少?
六、(本题包括2小题,你只需选做其中一个小题,若两小题全做则以30题计分.共8分)
30.(8分)北京6月2日讯,国家环保总局发布的《2004年中国环境状况公报》中指出下列内容:a.酸雨污染呈加重趋势 b.山西的临汾、阳泉、大同等三城市空气污染指数列全国113所环保城市前三位 c.七大水系中海河水系质量最差 d.我国城市人口占全国人口逾40%。由此根据所学知识回答:
(1)造成酸雨污染呈加重趋势的原因是(写一种) ________________________________。
(2)山西污染指数中首位是可吸人颗粒物,这与所处地区自然资源与工业生产直接相关。你认为造成空气中可吸人颗粒物增多的原因是(写一种)_________________________。
(3)取海河水系某支流河水分析,其主要污染物有较多悬浮物,河水呈碱性,水中含较多CO32—离子和有机物质(淀粉、蛋白质、洗涤剂等),还有大量病原体(如细菌、寄生虫等)。
① 用pH试纸测定河水酸碱度的方法是___________________________________________。
② 要除去水中的细小颗粒,可在水中加入______(填物质名称)作净水剂,然后静置处理。
③ 要除去水体中较多的CO32—离子,并使水体呈中性,可加入的物质是(写一种)_______。
④ 水体中有机物增加,水体溶解氧的能力会_______。(选填“增强”或“减弱”或“不变”)
⑤ 为有效消除水体中的病原体,可选用下列物质中的__________(选填序号)。
A.二氧化碳 B.漂白粉 C.氧气 D.石子和细砂
31.(8分)随着社会的进步,我国的汽车工业发展迅速。现在汽车的安全性增加了,尾气的排放更加符合国际标准。围绕这两项内容,回答下列问题:
(1)为保证驾乘人员人身安全,增设了安全气囊,汽车的安全气囊在汽车发生一定强度的碰撞时,利用叠氮化钠(NaN3)发生分解反应,迅速产生氮气和固态钠,气体充满气囊,以达到保护驾乘人员的目的。
① 写出叠氮化钠分解反应的化学方程式______________________________________。
② 若常温、常压下,要产生70L的氮气,则需要完全分解__________g的叠氮化钠。(已知:常温常压下,氮气的密度约为1.2g/L。)
(2)在汽车尾气系统中装置催化转化器。
① 催化转化器可有效降低尾气中的CO、NO、NO2和碳氢化合物等有害物质向大气中排放。催化转化器中通常采用铂等贵重金属作催化剂。请写出CO和NO在催化剂的作用下发生反应生成CO和N2的化学方程式______________________________。
② 催化转化器能减少一些有害气体的排放,但它并不能减少CO2气体的排放。CO2气体的大量排放能引起温室效应。为降低温室效应造成的危害,有人认为,空气中二氧化碳的含量越低越好,你认为这种说法是否正确?为什么? ________________
____________________________________________________________________。
常州市二○○五年初中毕业、升学统一考试
化学试题参考答案及评分标准
一、选择题(本题包括20小题,共40分)
1.C 2.D 3.A 4.B 5.B 6.C 7.A 8.D 9.D 10.B
11.A 12.B 13.A 14.B 15.D 16.B 17.C 18.C 19.D 20.A
二、(本题包括3小题,共20分)
21.(10分)(1)2H2O2===2H2O+O2↑ (2)Zn+2HCl=ZnCl2+H2↑
(3)H2SO4+2NaOH===Na2SO4+2H2O (4)C6H12O6+6O2→6CO2+6H2O
(1)、(2)(每个方程式2分,其余每空1分)
22.(5分)熟石灰、甲醛、碳酸氢铵、乙醇、陶瓷 (各1分)
23.(5分)(1)④ (2)② (3)⑤ (4)① (5)③ (各1分)
三、(本题包括2小题。共10分)
24.(3分)BCE(无错误选项,每对一个给1分;若有错误选项,错一个倒扣1分,但有两个错误选项该题就不得分)
25.(7分)(1)A(1分) (2)取出导管,量筒平放,视线与溶液凹液面的最低处相切(2分)
(3)没有(1分) (4)偏大(1分) (5)因为样品量太多会使液体外溢或气体外逸导致测量不准;太少会导致气体量太少,产生的气压不够,造成较大误差(2分)
四、(本题包括2小题。共12分)
26.(6分)(2)假设①不成立 假设②成立 假设③不成立(各1分) (3)有白色沉淀生成且溶液温度升高(1分) 过滤(1分) NaOH和Na2CO3(1分)(整体给分)
27.(6分)(1)B:O2 Y:CO2(各1分) (2)Fe+CuSO4==FeSO4+Cu(2分)
(3)2CO+O2===2CO2(2分)
五、(本题包括2小题,共10分)
28.(4分)解:(1)m(KCl)==500mL×l .1g/mL×10%==55g (2分)
(2)ω(KCl)==55g/(500mL×l.1g/mL+500mL×l.0g/mL)×100%=5.2%(2分)
答:溶液中含氯化钾55g。溶质的质量分数为5.2%。
29.(6分)解:(1)设样品中未被氧化的镁的质量为X
Mg+H2SO4==MgSO4+H2↑
24 2
X 0.18g
24/X==2/0.18g (1分)
X==24×0.18g/2==2.16g (1分)
(2)根据题意样品中氧化镁的质量为2.56g-2.16g==0.40g (1分)
0.4gMgO所含的Mg元素的质量为0.4g×24/40==0.24g (2分)
则m(Mg)==2.16g+0.24g==2.4g (1分)
或:设被氧化的镁的质量为Y
则2Mg+O2==2MgO
2×24 2×40
Y 0.40g
48/Y==80/0.40g (1分)
Y==2×24×0.40g/2×40==0.24g (1分)
则m(Mg)=2.16g+0.24g=2.4g (1分)
答:样品中未被氧化的镁的质量为2.16g。
镁条未被氧化时的质量是2.4g。
六、(本题包括2小题.你只需选做其中一个小题,若全做以30题计分。共8分)
30.(8分)(1)硫的氧化物的排放等(1分) (2)化石燃料的燃烧等(1分)
(3)①用玻璃棒蘸取河水滴在pH试纸上,然后与比色卡对照(1分)②明矾(1分)
③盐酸(1分) ④减弱(1分) ⑤B(2分)
31.(8分)(1)①2NaN3===2Na+3N2↑(2分) ②130g(2分)
(2)①2CO+2NO ==2CO2+N2(2分) ②不正确。因为大气中的二氧化碳参与自然界的许多变化,直接影响着我们的生活。没有二氧化碳,绿色植物就无法通过光合作用为其他生物提供食物和充足的氧气。(2分)
说明:
1.凡合理答案均相应给分。
2.对化学用语的评分仍要严格要求。具体要求为:
(1)书写化学方程式时,化学式有错不得分;配平、条件、生成物状态有错、计量数不是最简比、没写“==”(有机反应除外)等扣1分。
(2)化学专用名词写错别字,整体扣1分。
(3)元素符号书写不规范,整体扣1分。
3.解计算题格式必须规范。解题过程中,无设和答步骤、设未知量带单位、运算过程中物理量的数值不带单位、解得未知量的单位带括号等共扣1分。
4.最小得分值为1分。