江苏省苏州中学2005年国际班、科大少年预备班招生考试
化 学 试 卷
总分40分
可能用到的相对原子质量:H1 C12 N14 016 Na23 K39 Ca40 Fe56 Bal37
一、选择题(本题包括5小题,每小题2分,共10分。每小题只有1个选项符合题意。)
1.用★代表碳原子,用☆代表氧原子,则化学反应方程式2C+O2==2CO表示最合理的是
A.★★+☆☆==★★☆☆ B.★★+☆☆==★☆★☆
C.★+★+☆☆==★☆+★☆ D.★+★+☆+☆==★☆+★☆
2.已知硝酸是一种强氧化性酸,能把SO32-氧化成为S042-,则下列实验方案能够确定某未知试液中存在S042-的是
A.取少量试液,滴加BaCl2溶液,生成白色沉淀,再加入足量稀盐酸,沉淀不溶解
B.取少量试液,加入足量稀硫酸,没有明显现象,再滴加BaCl2溶液,生成白色沉淀
C.取少量试液,加入足量稀盐酸,没有明显现象,再滴加BaCl2溶液,生成白色沉淀
D.取少量试液,加入足量稀硝酸,没有明显现象,再滴加Ba(N03)2溶液,生成白色淀
3.某K2C03样品中含有Na2C03、KN03和Ba(N03)2三种杂质中的一种或二种。现将13.8克样品加入足量水,样品全部溶解,再加入过量的CaCl2溶液,得到9克沉淀。对样品所含杂质的正确判断是
A.肯定有Na2C03 B.肯定有KN03,可能还含有Na2C03
C.肯定没有Ba(N03)2,可能有KN03 D.肯定没有Na2C03和Ba(NO3)2
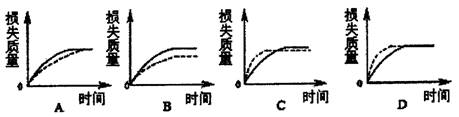
4.已知固体和液体的接触面积越大,反应的速率越快。现将a g块状碳酸钙跟足量盐酸反应,反应物损失的质量(不考虑盐酸的挥发)随时间的变化曲线如下图的实线所示,在相同的条件下,将b g(a>b)粉末状碳酸钙与足量同浓度盐酸反应,则相应的曲线(图中虚线所示)正确的是
5.已知一个SO2分子质量为n kg,一个SO3,分子质量为m kg,若以硫原子质量的![]() 作为原子质量的标准,则SO2的式量为
作为原子质量的标准,则SO2的式量为
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
二、填空题(本题包括4小题,共22分)
6.(4分)为了降低城乡居民因食物和饮用水中含碘量不足而导致碘缺乏症的发病率,我国已执行食盐加碘的法规,制定了“碘盐”的国家标准。市售二级碘盐的商品包装上标明“配料:食盐、碘酸钾;氯化钠含量:94%;含碘量:30mg/kg”。
(1)碘酸钾是碘元素(符号I)呈+5价的含氧酸的钾盐(不含结晶水),其化学式是 ;
(2)每千克市售的二级碘盐中,含有30mg的 ;
(3)制造碘盐并不直接使用碘(单质)而是使用碘酸钾,主要原因可能是(选填下列列举原因的序号) 。
(a)碘酸钾的价格较低,有利于减轻居民食用碘盐的经济负担
(b)碘酸钾较易溶于水,有利于碘盐生产操作,食用时无异味,易吸收
(c)碘酸钾热稳定性优于碘,有利于碘盐的生产贮放、使用过程中减少碘的损失
7.(4分)某中学环境监测兴趣小组的同学在一条鱼虾绝迹的小河边发现四个工厂,如下图所示。这些厂往小河里排放的废水中各含一种化合物,经监测发现:
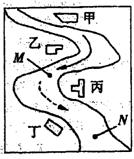 ①甲处河水呈浅黄色;②乙处河水呈红褐色浑浊状;③丙处河水逐渐变澄清;④丁处河水不断冒气泡;⑤M处水样的pH值大于7,加入足量的稀硝酸后再加入Bacl2溶液,无沉淀生成;⑥N处水样的pH值小于7。请回答四个工厂所排放的废水中,分别含有下列化合物中的哪些物质(用化学式表示)?
①甲处河水呈浅黄色;②乙处河水呈红褐色浑浊状;③丙处河水逐渐变澄清;④丁处河水不断冒气泡;⑤M处水样的pH值大于7,加入足量的稀硝酸后再加入Bacl2溶液,无沉淀生成;⑥N处水样的pH值小于7。请回答四个工厂所排放的废水中,分别含有下列化合物中的哪些物质(用化学式表示)?
硫酸铁、氢氧化钠、硝酸银、碳酸钠、氯化铁、稀硫酸
甲 、乙 、丙 、丁
8.(6分)Ag3P04、Ag2HPO4均为黄色沉淀。某同学向Na3PO4溶液中逐滴滴加硝酸银溶液至恰好完全反应,生成黄色沉淀,
(1)若黄色沉淀是Ag3P04,写出反应的化学方程式
(2)若黄色沉淀是Ag2HPO4,写出反应的化学方程式
(3)试设计一个简单的实验方案,来证明所生成的黄色沉淀是Ag3P04还是Ag2HPO4:
9.(8分)氨气是一种有强烈刺激性气味的气体,不宜直接排放到大气中。实验室用氨气还原氧化铜的方法测定铜的相对原子质量。已知:
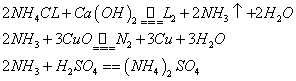
试回答:
(1)如果选用测定反应物CuO和生成物H2O的质量[m(CuO),m(H2O)],请用下列仪器设计一个简单的实验方案。
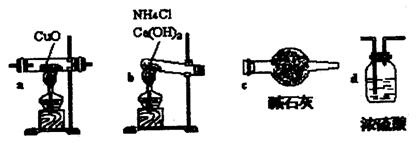
①仪器连接的顺序(用字母编号表示,仪器可重复使用) ;
②列出计算Cu的相对原子质量的表达式 ;
③下列情况将使测定结果偏大的是 (以下选择填空不限1个正确答案,均用字母编号填写)
(a)CuO未全部还原为Cu (b)CuO受潮 (c)CuO中混有Cu
(2)如果仍采用上述仪器装置,其他方案可选用测定的物理量有
(a)m(Cu)和m(CuO) (b)m(N2)和m(H2O) (c)m(Cu)和m(H2O) (d)m(NH3)和m(H2O)
三、计算题(本题包括1小题,共8分)
10.(8分)为测定一种混合氧化物(也称为多元氧化物,例如NiFe204,也可写成NiO·Fe203
的形式)的组成,称取12.52g 样品,将其全部溶于过量稀硝酸后,配成lOOmL溶液。取其一半,加入过量K2S04溶液,生成白色沉淀,经过滤、洗涤、烘干后得4.66g固体。在余下的50mL溶液中加入过量NaOH溶液,只生成一种红褐色沉淀,将沉淀过滤、洗涤、灼烧后得3.20g固体。
(1)计算样品中氧元素的质量分数(保留1位小数)。
(2)确定该混合氧化物的化学式。
江苏省苏州中学2005年国际班、科大少年预备班招生考试
化学试卷参考答案
1.C 2.C 3.B 4.C 5.B
6.KIO3 碘元素 bc
7.FeCl3 NaOH H2S04 Na2C03
8.Na3P04+3AgN03==Ag3P04↓+3NaN03
Na3P04+2AgN03+H20==Ag2HP04 ↓+2NaN03+NaOH
过滤,测滤液的pH值,pH>7为Ag2HPO4沉淀,pH=7为Ag3PO4沉淀
9.bcacd ![]() ac ac
ac ac
10.20.4% BaFe204或BaO·Fe203