眉山市仁寿县禾加学区2006级第三次中考适应性考试
化学试题
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。共四个大题,23小题,满分80分,考试用时约60分钟。
第Ⅰ卷用2B铅笔将考试科目和试题答案填涂在答题卡上。第Ⅱ卷写在答题纸上。
相对原子质量:H—1; O—16; C—12; Zn—65; Na—23; Fe—56; Mg—24; S—32;Cl—35.5
第 Ⅰ 卷
一、选择题(每小题只有一个选项符合题意,每小题3分,共45分)
 1、下列变化属于化学变化的是( )
1、下列变化属于化学变化的是( )
A、用玻璃刀裁玻璃 B、镁带燃烧 C、木炭净水 D、水沸腾
2、我们身边的下列物质,属于纯净物的是( )
A、食盐 B、消毒酒精 C、白醋 D、蒸馏水
3、下列物质的用途中,主要应用其化学性质的是( )
A、用氦气填充气球 B、用铜制作导线
C、用石墨作铅笔芯 D、用铁粉作食品保鲜剂
4、“神舟五号”载人飞机的成功发射,表明我国载人航天技术已达到国际领先水平,运载飞机的火箭发动机中使用了液氧,液氧的作用是(
)
A、支持燃料燃烧 B、冷却发动机 C、作为燃料 D、供给航天员呼吸
5、下列关于“2”的含义的解释中,正确的是( )
A、Zn2+中的“2+’表示锌粒带有2个单位的正电荷
B、2NO中的“2”表示2个一氧化氮分子
C、H2O中的“2”表示一个水分子中含有二个氢元素
-2
D、![]() 中化学式上方的“-2”表示3个硫酸根的化合价为-2价
中化学式上方的“-2”表示3个硫酸根的化合价为-2价
6、最新科技报道,夏威夷联合天文中心的科学家在宇宙深处发现H3+离子和H3分子,以下关于它们的说法不正确的是( )
A.H3+和H3都含有氢元素 B.H3是化合物
C.一个H3+中含有2个电子 D.一个H3中含有3个质子
7、据《广州日报》报道,为改善空气质量,2005年年底前广州市的所有公交线路将推广使用LPG(液化石油气,含C、H元素)清洁能源公交车。这项措施可以减少下列哪些气体对空气的污染: ①SO2 ②CO ③CO2 ④NO2 ( )
A.①② B.②④ C.①③ D.①④
8、在化学变化的前后,可能会改变的是( )
①分子的总数目 ②原子的总数目
③原子核中质子的总数目 ④某种元素的核外电子数目
A、②③ B、③④ C、①② D、①④
9、以下表示的是碳及其化合物的相互转化关系:
C![]() CO2
CO2![]() H2CO3
H2CO3![]() CaCO3
CaCO3 ![]() CO2
CO2
其中涉及的基本反应类型依次为( )
A、置换、化合、复分解、分解 B、置换、化合、分解、复分解
C、化合、置换、分解、复分解 D、化合、置换、复分解、分解
10、金属单质A和非金属单质B可生成化合物A2B,反应方程式2A + B = A2B,某校一课外小组的甲、乙、丙三个学生分别在实验室内做该实验,充分反应时,所用A、B质量各不相同,但总质量相等,都是8.0g,有关实验数据记录如下:则丙学生实验中a:b的值是( )
| A的用量 | B的用量 | A2B的质量 | |
| 甲 | 7.0g | 1.0g | 5.0g |
| 乙 | 4.0g | 4.0g | 5.0g |
| 丙 | a g | b g | 3.0g |
A、37∶3 B、3∶37 C、7∶3 D、4∶25
11、t0c,将一定量的某物质的不饱和溶液均分为三份,分别蒸发溶剂,然后把温度降至t0c。已知从三份溶液中蒸发的溶剂分别是10g,20g,30g ,析出的晶体不含结晶水,其质量分别是ag、 bg 、cg ,则a、 b、 c 三者关系正确的是( )
A、b=2a B、b=c-a C、b=(a+c)/2 D、b=(c-a)/2
12、剖鱼时若弄破鱼胆,胆汁沾在鱼肉上,使鱼肉有苦味。产生苦味的是胆汁酸,其pH约为6,且难溶于水。欲消除鱼肉上的苦味,可在沾有胆汁的地方涂上的物质是 ( )
A.纯碱溶液 B.食醋 C.食盐水 D.自来水
13、欲中和氯化钙溶液中的少量盐酸,在没有指示剂的条件下应选用的试剂是( )
A.碳酸钙粉末 B.生石灰粉末 C.熟石灰粉末 D.硝酸银溶液
14、小红配制了Na2SO4、Na2CO3、BaCl2、HCl四种溶液,因没及时贴标签而无法辨别,为将它们区别开来,把四种溶液编号为①②③④,并进行下列实验:
| 实验内容 | ①和②混合 | ②和④混合 | ①和③混合 |
| 实验现象 | 有白色沉淀生成 | 有白色沉淀生成 | 有气泡冒出 |
由以上现象可以确定①②③④依次为( )
A.HCl、Na2SO4、Na2CO3、BaCl2 B.BaCl2、Na2CO3、Na2SO4、HCl
C.Na2SO4、BaCl2、Na2CO3、HCl D.Na2CO3、BaCl2、HCl、Na2SO4
15、已知同温同压下,同体积的任何气体具有相同的分子数。将9ml CO、CO2和O2组成的混合气体点燃引爆后,恢复到原来状态体积减少了1ml,在通过足量的澄清石灰水后,体积减少了5ml。则原来混合气体中CO、CO2、O2的体积比可能是( )
A、5:1:3 B、1:5:3 C、2:3:4 D、3:1:5
第 Ⅱ 卷
二、填空题(22分)
16、(4分)在C、H、O、N、Na Ca元素中,选择适当的元素组成符合下列要求的物质,将化学式填入空格中:
(1)空气中体积分数最大的单质 (2)天然气的主要成分
(3)可改良酸性土壤的碱 (4)一些食品包装袋中的干燥剂
17、(3分)请你按照一定的规律用化学式填写下列空格:
(1)醋酸、氢氧化钾、食盐水三种溶液按PH由大到小排列:
(2)水银、铜丝、铝片、镁带四种金属按金属活动性由强到弱排列:
(3)按氯元素化合价由低到高排列:KCl、 、HClO、KClO3、NaClO4
18、(3分)托盘天平的两边分别放盛有一定量等同质量分数、等同体积稀盐酸的小烧杯,天平平衡,分别向两烧杯中加入等同质量的镁和锌,充分反应后,天平仍平衡,则在上述反应中一定全部反应的是 ;一定有剩余的是 ;
可能有剩余的是 。
19、(4分)硒元素(元素符号:Se)具有抗衰老、抑制癌细胞的功能。硒的某含氧酸中硒元素的化合价与硫酸中硫元素的化合价相同,化学性质与硫酸相似。
(1)这种硒的含氧酸的化学式为 ,应读做 ;
(2)这种硒的含氧酸与烧碱发生中和反应的化学方程式为:
。
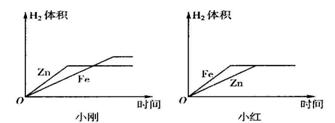 20、(4分)小刚与小红分别做相同质量的不同金属与同质量、同质量分数的稀H2SO4反应的实验,实验结束后,分别交上的实验报告,并绘制出金属Zn、Fe分别与稀H2SO4反应放出H2的函数图像(如图所示)。
20、(4分)小刚与小红分别做相同质量的不同金属与同质量、同质量分数的稀H2SO4反应的实验,实验结束后,分别交上的实验报告,并绘制出金属Zn、Fe分别与稀H2SO4反应放出H2的函数图像(如图所示)。
(1)两个图像中存在有错误的是 的图像,判断错误的理由是
;
(2)由该实验可以得到的结论:
①金属与酸反应的速率与 有关。
②金属与酸反应中若生成盐中金属价态相同,则生成的氢气量与 有关。
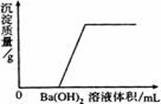 21、(4分)某溶液由NaOH、HCl、H2SO4、HNO3和MgCl2中的一种或几种组成。向该溶液中滴加Ba(OH)2 溶液,产生沉淀的质量与加入Ba(OH)2
溶液体积的关系如右图所示。请你从图中获得的信息来分析,
21、(4分)某溶液由NaOH、HCl、H2SO4、HNO3和MgCl2中的一种或几种组成。向该溶液中滴加Ba(OH)2 溶液,产生沉淀的质量与加入Ba(OH)2
溶液体积的关系如右图所示。请你从图中获得的信息来分析,
如果该溶液中含有其中的两种,则该溶液中溶质的组成可能为
① 和 ;
② 和 。
三、实验题(7分)
22、某化学探究小组的同学为了测定某不纯氧化铁试样(其中杂质不参与反应)中氧化铁的质量分数,设计了如图所示的实验装置:试回答下列问题:
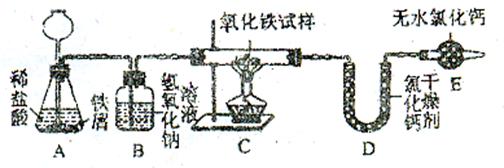
(1)写出A中发生的化学方程式 ;
(2)B的作用是 ,D和E中均装有无水氯化钙干燥剂,D的作用是 ,E的作用是 ;
(3)小强同学通过称量反应前后D部的质量来计算氧化铁的质量分数,若按这一方案过行实验并记录数据,则计算结果与实际值相比将 (填“偏大”、“偏小”、“相同”),对此谈谈你对这个实验方案的评价与改进建议
。
四、计算题(6分)
23、现一块铜合金,可能是黄铜(铜锌合金)、青铜(铜、锡合金)、白铜[铜、镍(Ni)合金]中的一种,现欲测定其组成。
[查阅资料] Ⅰ.锌、锡、镍皆能与稀硫酸发生置换反应,生成+2价的金属离子;
Ⅱ.相对原子质量Zn—65,Sn一119,Ni一59。
[实验步骤及数据] 取5g合金粉碎后放入烧杯中,将20g15%稀H2SO4分四次加入烧杯中充分反应后,测定剩余固体质量数据记录如下:
| 次 数 | l | 2 | 3 | 4 |
| 加入酸质量/g | 5.0 | 5.0 | 5.0 | 5.0 |
| 剩余固态质量/g | 4.5 | 4 | 3.5 | 3.2 |
试求:①合金中铜的质量分数。②合金中另一金属为何种金属。
参考答案
一、选择题
1、B 2、D 3、D 4、A 5、B 6、B 7、D 8、D 9、A 10、A 11、C
12、A 13、A 14、D 15、C
二、填空题
16、(1)N2 (2)CH4 (3)Ca(OH)2 (4)CaO
17、略
18、(1)稀盐酸 (2)Mg (3)Zn
19、(1)H2SeO4 ;硒酸
![]() (2)H2SeO4+2NaOH Na2SeO4+2H2O
(2)H2SeO4+2NaOH Na2SeO4+2H2O
20、(1)小红 图像中Fe与Zn标反了,Zn的反应速率较Fe快
(2) ①金属活动性 ②相对原子质量
21、 ①HCl、MgCl2; ②HNO3、MgCl2
三、实验题
22、(1)Fe + 2HCl = FeCl2 + H2↑
(2)吸收逸出的氯化氢气体 吸收反应产生的水
防止空气中的水进入D装置中
(3)偏大 B中逸出的水蒸气被D吸收,造成结果偏大;建议在B、C之间增加一个盛浓硫酸的洗气瓶
四、计算题
23、①64%
②另一种金属为锌。