中山教育教学联合体下学期初三第二次联考
化学试卷
学校 姓名 班级 考号
提示:(1)本试卷分选择题和非选择题两部分。满分共100分。考试时间80分钟。
(2)答案请写在答题卡上。
相对原子质量:H 1 C 12 N 14 O 16 Cu 64 Fe 56 Ag 108 Cl 35.5 Na 23 S 32
一、我会选(本题包括15小题,每小题2分,共30分。每小题只有一个选项符合题意)
1.成语是中华民族语言的瑰宝。下列成语中,其本意主要为化学变化的是
A.铁杵磨成针 B.死灰复燃 C.木已成舟 D.积土成山
2.2005年中央电视台春节联欢晚会上,各省市用对联的形式向观众拜年,其中青海省的上联是:水泽源流江河湖海 ,甘肃省的下联是:金银铜铁铬镍铅锌。联中的“金银铜铁铬镍铅锌”属于
A.金属 B.合金 C.氧化物 D.非金属
3.下列物质的用途主要是由其化学性质决定的是
A.用铝作导热材料B.用铜抽成丝做电线C.用氮气作食品防腐剂D.用活性炭做吸附剂
4.某饮料的配料表如下:纯净水、蔗糖、苹果汁、维生素C、乳酸钙。此饮料不含的营养素是
A.糖类 B.维生素 C.水 D.油脂
5.明代爱国将领于谦的《石灰吟》: 千锤万凿出深山,烈火焚烧若等闲; 粉身碎骨浑不怕,要留清白在人间。该诗体现了诗人的崇高情操和献身精神。诗中蕴含着石灰的来源、生产、性质、用途等化学事实。下列化学变化中与诗意无关的是
A.CaCO3CaO+CO2↑ B.CaO+H2O=Ca(OH)2
 |
C.Ca(OH)2+CO2=CaCO3↓+H2O D.CaO+2HCl=CaCl2+H2O
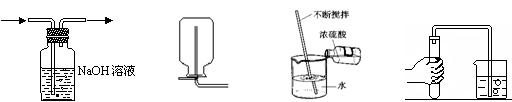
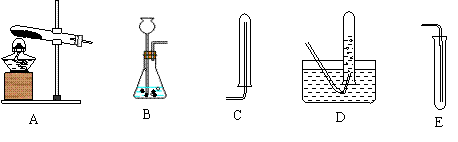
6.下图是初中化学常见的几个实验操作,其中错误的是
A B C D
![]()
7.佛山是陶瓷之乡,石湾陶瓷闻名全国。氮化硅(Si3N4)是一种新型陶瓷材料的主要成分,能承受高温,可用于制造业、航天工业等。氮化硅中氮的化合价是
A.-3 B.+3 C.+4 D.+5
8.“市民利益无小事,食品安全是大事”。下列做法不会导致食品对人体有害的是
A.用工业用盐腌制“咸酸菜” B.用甲醛溶液浸泡海鲜产品
C.牛奶经工业发酵后得到的酸奶 D.食用霉变的大米、花生
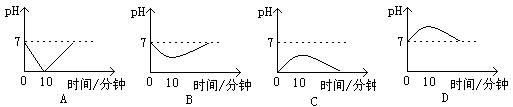 |
9.人类口腔内唾液的pH在进食过程中和进食后会发生变化。一般来说从进食开始至10分钟,酸性逐渐增强,10分钟至40分钟酸性逐渐减弱并趋于正常。与上述事实符合的函数图像是
 10.英国《新科学报》报道火星赤道上有“冰海”。该区域成为人类寻找火星生命的首选地点,下列说法中不正确的是
10.英国《新科学报》报道火星赤道上有“冰海”。该区域成为人类寻找火星生命的首选地点,下列说法中不正确的是
A.水是生命之源 B.水是人体必须的营养物质之一
C.水是由氢元素和氧元素组成的
D.一个水分子是由一个氢分子和一个氧原子构成的
11.纽约大学的科学家最近研制出有“双腿”、能在盘子里“散步”的分子机器人。它是由26个氨基酸结合而成的有机高分子。下列说法正确的是
A.我们已可以用肉眼直接看到这种分子“散步” B.这种分子机器人是一种新型分子
C.分子本身是不会运动的,其“散步”一定是在人的推动下进行的
D.这种分子组成的物质是一种单质
12.下列说法中不正确的是
A.任意丢弃塑料食品袋、塑料薄膜等会造成“白色污染”
B.大气中CO2含量不断增加,会使温室效应增强,全球变暖
C.棉布是用有机合成材料制成的 D.硝酸钾在种植业中可用作复合肥料
13.在进行“空气中的氧气会减少耗尽?”的辩论中,作为正方(空气中的氧气会减少耗尽)。下列论点不应成为本方论据的是
A.汽车越来越多,消耗的氧气越来越多
B.限制二氧化硫等有害气体的排放是目前各国政府的重要环境政策
C.有证据表明,在远古时代的原始空气中氧气含量高达30%
D.人口增多,人类所消耗的燃料越来越多
14.对加热分解过氧化氢溶液的实验,小明假设:“难制得氧气的原因是加热初期
有大量水蒸汽产生”,他设计了下列实验方案,其中不能对此假设提供较好实证的是
A.分别使用不同催化剂进行过氧化氢溶液的分解实验 B.使用生石灰干燥生成的气体
C.使用浓硫酸干燥生成的气体 D.延长加热时间,让水蒸汽先逸出后再检验生成的气体
15.对于反应A+B=C+D来说,下列说法错误的是
A.若生成物C、D分别为氯化钠和水,该反应一定是中和反应
B.若A、C为单质,B、D为化合物,该反应一定是置换反应
C.若A、B、C、D都是化合物,则该反应可能是复分解反应
D.参加反应的A、B的质量之和一定等于生成的C、D的质量之和
二.我会填(本题包括4题,共18分)
16.(3分)下图为四种粒子的结构示意图,用对应的序号填空:
![]()
(1) 具有相对稳定结构的粒子是 ; (2) 属于同种元素的粒子是 ;
 (3) 某元素R形成的碱的化学式为R(OH)2,则R元素对应原子的原子结构示意图可能是 。
(3) 某元素R形成的碱的化学式为R(OH)2,则R元素对应原子的原子结构示意图可能是 。
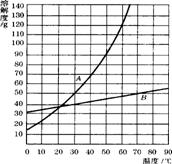
17.(3分)右图是A、B两种固体物质的溶解度曲线,请回答下列问题:(1)在50℃时,A的溶解度为 g;
(2)当温度等于30℃时,A的溶解度 (填“大于”、“小于”或“等于”,下同)B的溶解度;
(3)10℃时,A物质饱和溶液溶质的质量分数 B物质饱和溶液溶质的质量分数。
18.(8分)中山市等珠江三角洲城市将建立压缩天然气管道输送网络。
(1)天然气代替燃煤是防止空气污染的措施之—。请写出天然气燃烧的化学方程式: 。
(2)在某种氧化物作用下,可使汽车尾气中CO和NO反应,并转化为两种气体。其中一种可以参与植物的光合作用,另—种是空气中含量最多的气体,这两种气体是(写化学式) 和 。
(3)氢气是理想的清洁能源,目前被认为最好的储氢方法是金属储氢法。氢化钠(NaH)是—种常用的生氢剂,遇水后放出H2并生成—种碱。
试写出该反应的化学方程式: 。
(4)近期世界石油价格飙升,寻找替代能源具有重要的现实意义。请写出能代替汽油来驱动汽车、具有开发前景的二种能源: 、 。
19.(4分)葛洪是我国晋代著名炼丹家。一次,葛洪之妻鲍姑用铁勺盛“曾青”(硫酸铜溶液)。几天后,葛洪发现了一个奇妙的现象:铁勺变成“铜勺”,葛洪的徒弟高兴得跳了起来:“点铁成金啦!”葛洪把“铜勺”放在火上一烤,“铜勺”逐渐变黑。这些在《黄白篇》一书中作了记载。
(1)写出“点铁成金”的化学方程式: 。
(2)“铜勺”变黑的反应属于化学反应基本类型中的 。
(3)葛洪在炼丹过程中常用到一种名叫“黄丹”的物质。如果“黄丹”与硝酸反应的化学方程式为: “黄丹”+4HNO3=PbO2+2Pb(NO3)2+2H2O,请你推测“黄丹”的化学式是 。
 三.我会答(本题包括4小题,共22分)
三.我会答(本题包括4小题,共22分)
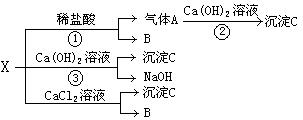
20.(5分)X是常见固态化合物,可发生下图所示的变化:
(1)X的化学式是 。
(2)写出图中②、③反应的化学方程式:②
③
21.(5分)对大量实验进行分析,找出一些规律,并根据这些规律和物质的内在联系,对一些物质的性质进行分析做出猜测,是化学学习和研究的重要方法。试仿照下表中事例,以初中学过的酸、碱、盐的化学性质为例,填写所有空格(所填规律不能重复):
| 实验事实(每空至少举2实例) | 规 律 | 推测同类物质具有相同性质 |
| 示例:盐酸、稀硫酸都能使紫色石蕊试液变红 | 酸溶液都能使紫色石蕊试液变红 | 醋酸也能使紫色石蕊试液变红 |
| (1)碳酸钠、碳酸钙都能与稀盐酸反应,生成使澄清石灰水变浑浊的无色无气味的气体。 | ① | ② |
| (2)③ | ④ | ⑤ |
22.(6分)我市某地水产养殖场的鱼突然大量死亡。闻讯后,小强取回水样和同学们一起探究。
(1) 取过滤后的水样测酸碱性。请用两种不同的物质来检验水样是否显酸性,你选用的物质是 、 。
(2)面对河涌水质严重污染,有同学建议:①建造生活污水处理厂;②将西江水引入,把区域内的污水及污泥冲走,使水质提高;③使用成本低,效果好,不产生二次污染的生物酶技术治理区内水域;④建立城市垃圾处理系统。以上建议你不同意的是:
(填序号),理由是 。
(3)水是一种重要的自然资源。近年广东因降雨量少海水倒灌而引起“咸潮”,需调广西、贵州的淡水来压“咸潮”,下列有关认识或观点,你认为正确的是
A.水分子可通过光学显微镜观察到。
B.天然降水洁净清澈,提倡直接作为饮用水。
C.盛开水的热水瓶底常沉积一层水垢,这说明自来水不是纯净物。
D.洗菜、淘米、洗衣的水用来浇花、拖地、冲厕所。
23.(6分)已知明矾[KAl(SO4)2·12H2O]在水中可解离出K+、Al3+和SO42-。小萍同学为探究明矾中何种离子起净水作用,做了如下实验,请你帮她完成实验报告。
| 实验操作 | 实验现象 | 结论 |
| 在一杯浑浊的水中加少量Al2(SO4)3,静置 | ① | Al2(SO4)3起净水作用 |
| 在一杯浑浊的水中加少量KCl,静置 | 烧杯中的水仍然浑浊 | ② |
有同学认为以上方案中只是证明了:Al2(SO4)3可以净水,K+不能净水,不够完善。
请你仔细分析以上实验报告并将你完善实验所用的试剂及的目填入下表中:
| 使用的试剂 | 实验目的 |
| ③ | ④ |
| ⑤ | ⑥ |
四.我会实验(本题包括3小题,共20分)
24.(3分)实验室里将粗盐制成精盐的过程中,在溶解、过滤、蒸发三个步骤的操作中都要用到玻璃棒,分别说明在这三种情况下玻璃棒的作用。
(1)溶解时: 。
(2)过滤时: 。
(3)蒸发时: 。
25.(10分)有一固体物质与一种液体接触时,产生大量无色气体。
(1)请你对产生的气体做出一种假设(或猜想),并设计实验证实你的假设(或猜想)。
| 假 设(或猜想) | 验证方法及操作 | 观察到的实验现象 | 结论 |
| ①
| ②
| ③
| ④
|
(2)实验室里如果要制取该气体,你选择的药品是 、 。发生装置应选择下图装置中 ,收集装置应选择 。
(3)反应的化学方程式是 。
26.(7分)味精是烹制菜肴时常用的调味品,其主要成分是谷氨酸钠。谷氨酸钠有鲜味,易溶于水。小明发现某品牌味精包装上标注:“谷氨酸钠含量≥80%,NaCl含量≤20%”。他想测定此味精中NaCl的含量。
查资料:NaCl+AgNO3=AgCl↓+NaNO3,谷氨酸钠存在不影响NaCl性质。
实验过程:
①称取该味精样品5.0 g,并溶于蒸馏水;②加入过量的硝酸银溶液;③过滤;④用蒸馏水反复洗涤沉淀多次;⑤将沉淀烘干、称量,测得固体质量为2.87g。
根据上述实验步骤回答下列有关问题:
⑴过滤操作所需要的仪器除烧杯、铁架台(带铁圈)、玻璃棒外,还需要的玻璃仪器是 。
⑵此样品中NaCl的质量分数为 ,是否符合其包装上标注的标准?
。
应用:最近专家否认了“味精致癌”的说法。实验表明,味精在100℃时加热半小时,只有0.3%的味精(谷氨酸钠)生成焦谷氨酸钠(有毒),其对人体的影响甚微。对此下列认识正确的是 。
A.谷氨酸钠受热不发生化学变化
B.谷氨酸钠在加热下生成焦谷氨酸钠是物理变化
C.大量食用味精不利于身体健康
D.研究问题的一种有效方法是通过实验
五.我会计算(本题包括2小题,共10分)
27.(4分)近日,世界卫生组织和联合国粮农组织联合发出警告, 含有致癌毒素——丙烯酰胺(Acrylamide)(简称“丙毒”)的食品会严重危害人的健康,特别是“洋快餐”的多种食物中均含有大量“丙毒”。丙烯酰胺在一定条件下燃烧生成二氧化碳、水和一氧化二氮三种物质。经测定,14.2 g“丙毒”可与25.6g氧气恰好完全反应,生成26.4g二氧化碳和9.0g水。试计算判断:
(1)不经计算请你判断,组成“丙毒”的元素一定有 元素;
(2)反应生成一氧化二氮的质量是 g。
28.(6分) 2005年1月1日起,各地环保部门将对实验室类污染实施严格的环境监管。某校实验室里有50kg氢氧化钠废液,该校用某化工厂废弃的稀硫酸来中和后排放。当测得溶液pH=7时,中和后溶液的总质量为100 kg,测得反应后的溶液中溶质的质量分数为7.1%,求:
(1)反应生成的硫酸钠的质量是多少?
(2)所用的稀硫酸中溶质的质量分数为多少?
(3)该校实验室的氢氧化钠废液中溶质的质量分数是多少?
模拟考试参考答案及评分标准
化 学
说明:1. 化学专用名词中出现错别字均不给分。
2.方程式中化学式错误不给分,未配平或未写反应条件或不标状态各扣0.5分。
3. 若考生写出与本答案不同的其它合理答案,可参照评分标准给分。
一、选择题(每小题只有一个正确选项符合题意。将正确选项的字母编号填入下列表格内,每小题2分,共30分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 |
| 答案 | B | A | C | D | D | B | A | C | B | D | B | C | B | A | A |
二、(共4小题,共18分)
16.(3分) (1) A D (2) B D (3) B (每空1分)
|
18.(8分)(1) CH4 + 2O2 = CO2 + 2H2O (2分)
(2) CO2 (1分) N2 (1分)
(3) NaH + H2O = NaOH + H2↑ (2分)
(4) 酒精 (1分) 氢气(其他符合题意的也可)(1分)
19.(4分) (1) Fe + CuSO4 = FeSO4 + Cu (2分)
(2) 化合反应 (1分) (3) Pb3O4 (1分)
三、(共4小题,共22分)
20.(5分) (1) Na2CO3 (1分)
(2) Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑ (2分)
Ca(OH)2 + Na2CO3 =CaCO3↓+ 2NaOH (2分)
21.(5分) (1) 碳酸盐都能与稀盐酸反应,生成使澄清石灰水变浑浊的无色无味的气体。
碳酸镁(或其他碳酸盐也可)也能与稀盐酸反应,生成使澄清石灰水变浑浊的无色无味的气体。
(2) 氯化钠、氯化钙都能与硝酸银溶液反应,生成不溶于稀硝酸的白色沉淀。
可溶性氯化物(或盐酸盐)都能与硝酸银溶液反应,生成不溶于稀硝酸的白色沉淀。
氯化钾也能与硝到另一个地方,污染依然未消除。 (以上每空1分)
(3) C D (2分)
23.(6分)(每空1分)烧杯中的水变澄清 K+(或钾离子)不能起净水作用
AlCl3[或Al(NO3)3等,写名称一样] 验证Al3+(或铝离子)的净水作用
Na2SO4等(写名称也可) 验证SO42-(或硫酸根离子)的净水作用
四、(共3小题,共20分)
24.(3分) 搅拌,加快溶解; 引流作用; 搅拌,防止液滴飞溅。(各1分)
25.(10分) (1)气体是CO2 将气体通入澄清石灰水中 澄清石灰水变浑浊 该气体是CO2
(2)石灰石(或大理石); 稀盐酸; B; E
(3)CaCO3+2HCl = CaCl2 + H2O +CO2↑
(或其它合理的答案如H2、O2也可,但前后须一致,每空1分,方程式2分)
26.(7分) (1)(1分)漏斗 (2)(3分) 23.4% (1分)不符合 “应用”(2分) C D (单选且正确得1分,多选只要选错一个,该空不得分)
五、(共2小题,共10分)
27.(4分) (每空2分,(1)空只答1个不得分,答2个且对得1分)(1) C、H、N (2) 4.4g
28.(6分)解:生成Na2SO4质量=100kg×7.1%=7.1kg (1分)
设:稀硫酸中硫酸的质量为x,氢氧化钠溶液中氢氧化钠的质量为y.
H2SO4 + 2NaOH = Na2SO4 + 2H2O
98 80 142
x y 7.1kg
![]() (1分)
(1分)
x=4.9kg (1分) y=4kg (1分)
⑴![]() (1分)
(1分)
⑵![]() (1分)
(1分)
答:略
酸银溶液反应,生成不溶于稀硝酸的白色沉淀。(每空1分)
22.(6分)(1) 紫色石蕊溶液 pH试纸 (或其它合理的答案也可)
(2) ② 方案②只能将区域内的污水及污泥冲走,只是将污染从一个地方转移