盐城第一初级中学2006年初三模拟考试
可能用到的相对原子质量:
H:1 C:12 O:16 Cl: 35.5 Ca:40 Zn:65
第I卷(选择题 共40分)
一、选择题(本大题共20小题,每小题2分,共40分。每小题只有一个选项符合题意,请将符合题意的选项序号填入括号中)
1.在我们生活的物质世界里,不仅存在着形形色色的物质,而且物质还是在不断地变化着的。以下变化属于物理变化的是 ( )
A.大米酿酒 B.菜刀生锈 C.瓷碗破碎 D.食物腐败
2.化学上研究任何物质的性质都必须取用纯净物。下列属于纯净物的是 ( )
A.不锈钢 B.冰醋酸 C.汽油 D.纯净的盐酸
3.下图表示的是身边一些物质的近似pH。有关这些物质的比较和判断正确的是 ( )
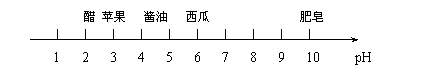
A.醋的酸性比酱油弱 B.西瓜汁显中性
C.肥皂水的碱性最强 D.苹果汁显碱性
4.园林工人常在树干下部涂上一层石灰浆,其作用是 ( )
A.美观 B.杀菌 C.标记 D.以上都不对
5.我国的“神舟六号”载人飞船已发射成功,“嫦娥”探月工程也已正式启动。据科学家预测,月球的土壤中吸附着数百万吨的氦(He-3),其原子核中质子数为2、中子数为1,每百吨氦(He-3)核聚变所释放出的能量相当于目前人类一年消耗的能量。下列关于氦(He-3)元素的说法正确的是 ( )
![]() A.原子核外电子数为3
B.相对原子质量为2
A.原子核外电子数为3
B.相对原子质量为2
![]() C.原子结构示意图为
D.原子结构示意图为
C.原子结构示意图为
D.原子结构示意图为
6.稀盐酸、稀硫酸具有一些共同的化学性质,其主要原因是 ( )
A.所有酸的组成、结构都相同 B.酸溶液中都含有酸根离子
C.酸溶液中阳离子都是氢离子 D.酸溶液都能使石蕊变红
7.通过化学反应产生下列现象:①燃烧 ②火药爆炸 ③缓慢氧化 ,需要具备的条件由多到
少的是 ( )
A.①②③ B.①③② C.③②① D.②①③
8.下列物质中有一种与其他三种都能发生反应,这种物质是 ( )
A.铁 B.碳酸钙 C.稀盐酸 D.氢氧化钠
9.下列反应属于复分解反应的是 ( )
A.CO2+Ca(OH)2=CaCO3↓+H2O B.CaO+H2O=Ca(OH)2
C.CaCO3 高温 CaO+CO2↑ D.CaO+2HCl=CaCl2+H2O
10.化学实验是学习化学的重要方法,在实验时必须注意实验安全。下列实验操作不符合实验安全要求的是 ( )
A.点燃氢气前先检验纯度 B.稀释浓硫酸时将水倒入浓硫酸中
C.加热液体时,试管口不对着有人的方向 D.实验室的药品不能带出实验室
11.下列化学方程式书写不正确的是 ( )
A.2Fe+6HCl=2FeCl3+3H2↑ B.Cu+2AgNO3=Cu(NO3)2+2Ag
C.SO2+2NaOH=Na2SO3+H2O D.BaCl2+Na2SO4=BaSO4↓+2NaCl
12.用蒸馏水配成的某盐溶液,加入硝酸使其呈酸性,再加入氯化钡溶液有白色沉淀。对此
盐的判断正确的是: ( )
A.可能是碳酸盐 B.肯定不是碳酸盐 C.肯定是硫酸盐 D.肯定不是硝酸盐
13.我国化工专家侯德榜先生早在1929年改进了一种化工产品的工业生产技术,其产品获美国费城万国博览会金奖。这种生产技术是 ( )
A.烧碱的生产 B.粗盐的精制 C.纯碱的生产 D.尿素的生产
14.环境污染已成为人类社会面临的重大威胁。下列名词与环境污染无关的是 ( )
A.潮汐 B.酸雨 C.臭氧层空洞 D.工业三废
阅读下列材料,回答15~16题
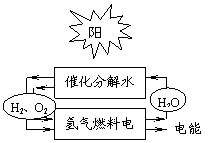 目前,循环经济已经成为经济生活中的热门话题。从 物质转化角度看,
循环经济是化学物质循环流动性经济,即“资源——产品——再生资源”;而传统的工业生产是一种单向流动的线形经济,即“资源——产品——废物”。氢气是未来理想的能源,水是未来氢气之源。理想的氢元素循环如右图所示。氢气是高效清洁的新能源,但近来有研究表明,氢气的大量使用可能会大面积破坏臭氧层。
目前,循环经济已经成为经济生活中的热门话题。从 物质转化角度看,
循环经济是化学物质循环流动性经济,即“资源——产品——再生资源”;而传统的工业生产是一种单向流动的线形经济,即“资源——产品——废物”。氢气是未来理想的能源,水是未来氢气之源。理想的氢元素循环如右图所示。氢气是高效清洁的新能源,但近来有研究表明,氢气的大量使用可能会大面积破坏臭氧层。
15.下列观点不正确的是 ( )
A.推行循环经济有利于解决我国的能源危机、资源短缺、环境污染等问题
B.化学反应不仅能为人类提供有用的物质,而且能够消除对人类有害的物质
C.从循环经济的角度看,废物就是放错了位置的资源
D.在“资源——产品——废物”的生产过程中,不遵守质量守恒定律
16.对于理想的氢元素循环,下列说法不正确的是 ( )
A.水的分解反应需要吸收能量 B.燃料电池将氢能转化为电能
C.该循环中共出现两种形式的能量 D.氢能源目前尚不能广泛使用
17.农村有句谚语“雷雨发庄稼”,这是由于在放电条件下,空气中的氧气和氮气化合生成了氮的氧化物,氮的氧化物再经过各种复杂的化学变化,最后生成了易被农作物吸收的硝酸盐。雷雨给庄稼施加了 ( )
A.氮肥 B.磷肥 C.钾肥 D.复合肥
18.在元旦晚会上,玲玲同学向观众展示一张事先准备好的白纸,然后向白纸上喷上一种无色溶液,结果白纸上出现“科学探究”几个红字。下列说法不正确的是 ( )
A.“科学探究”几个字可能是事先用毛笔蘸稀盐酸写上的
B.“科学探究”几个字可能是事先用毛笔蘸酚酞试液写上的
C.“科学探究”几个字可能是事先用毛笔蘸NaOH试液写上的
D.白纸上喷上无色液体时,有化学变化发生
19.下列物质中不能将BaCl2、HCl、NaOH 三种无色溶液一次鉴别出来的是 ( )
A.CuSO4 B.Na2CO3 C.AgNO3 D.石蕊试液
20.为了测定某石灰厂的石灰中碳酸钙的质量分数,学校研究性学习小组取来了一些样品,并取稀盐酸200g,平均分成四组,进行实验,结果如下:
| 实验 | 1 | 2 | 3 | 4 |
| 加入样品的质量/g | 5 | 10 | 15 | 20 |
| 生成CO2的质量/g | 1.76 | 3.52 | 4.4 | m |
则下列推断不正确的是 ( )
A.实验2中碳酸钙恰好与稀盐酸完全反应 B.m=4.4
C.实验3中样品有剩余 D.石灰石中碳酸钙的质量分数为80%
第Ⅱ卷(非选择题 共60分)
二、填空题(本大题共6小题,计34分)
21.(8分)初中学习了氢、氧、碳、铁等元素的单质及化合物的知识。请回答:
⑴由H、O、C、Fe组成的常见化合物中,属于可燃性气态单质的是 ,属于无机含氧酸的是 ,属于碱的是 ,属于酸性氧化物的是________,炼钢工业中常用的一种气体是 ,最简单的有机物是 (以上空格均填化学式)
⑵碳的几种单质物理性质不同的原因: 。
⑶用H2作燃料比CO作燃料好,主要表现在: 。
22.(4分)溶解度曲线为我们定量描述物质的溶解性强弱提供了便利。请你根据右图的溶解度曲线回答下列问题:
⑴20℃时,甲物质的溶解度_____ 乙物质的溶解度

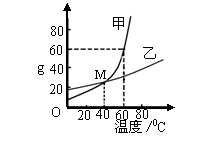 (填“>”、“=”或“<”);
(填“>”、“=”或“<”);
⑵60℃时,将等质量的甲乙两物质恰好完全溶解,需要水
较少的物质是 ;
⑶60℃时,将40 g 甲的是放入50 g水中,充分溶解所得
溶液的质量为 g ;
(4) 当甲物质中混有少量乙物质时,可用 方
法提纯甲物质 (选填“过滤”、“蒸发结晶”、“降温结晶”)。
23.(8分)按要求完成下列化学方程式
⑴写一个中和反应
⑵用稀盐酸除铁锈
⑶将铁丝插入硫酸铜溶液
⑷实验室用石灰石和稀盐酸制取二氧化碳
24.(3分)用“>”、“=”、“<”填空:
⑴V1ml水和V2ml酒精混合得混合液体积V3ml,则V1+V2_______V3.
⑵20℃时,100g Ca(OH)2饱和溶液中溶质质量分数为a1%,60℃时200gCa(OH)2饱和溶液中溶质质量分数为a2%,则a1%_______a2%。
⑶质量为A g的锌片插入某硫酸铜溶液中,一段时间后取出附有铜的锌片,称得其质量为B g,则A B。
25.(5分)由于氢氧化钠固体不仅会吸收 而潮解,而且会吸收空气中的 而变质,因此必须密封保存;为了检验长期露置在空气中的氢氧化钠溶液是否变质,可以选择三种不同物质类别(酸、碱、盐)的试剂进行实验。请你写出所选试剂的化学式:酸 、碱 、盐 。
26.(6分)以下是A、B、C、D、E、甲、乙几种物质相互转化的关系图:
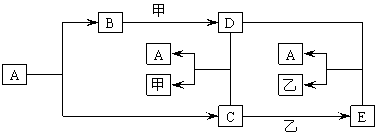 |
其中A是大理石的主要成分,甲是常用的重要溶剂,乙溶液中阳离子为Na+。
⑴写出下列物质的化学式:
A: ;B: ;甲: ;乙: 。
⑵写出D和E反应的化学方程式: 。
三、实验题(本大题共2小题,计14分)
27.(4分)过氧化氢(H2O2)水溶液是医疗上常用的一种消毒液,常温时在二氧化锰催化剂的作用下,可以发生分解反应,产生一种无色、无味的气体。
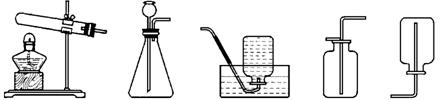
A B C D E
根据上述所给资料和实验装置,回答下列问题:
⑴请你猜测,产生的气体可能是 ;
⑵在实验室用上述原理制取这种气体,可选用的发生装置是 (填序号);
⑶若要收集这种气体,能选用的装置是 (填装置序号);
⑷请设计实验,验证你的猜测(简要叙述实验步骤、现象和结论)
。
28.(10分)某黑色物质可能是CuO、C中的一种或两种,小宇同学为研究该黑色物质,设计如下方案(若有C存在,含量较少):
【研究成分】小宇同学设计的两个实验方案如下:
![]()
甲:黑色粉末 观察溶液颜色观察现象
![]() 乙:黑色粉末
产物与白色硫酸铜接触
观察现象
乙:黑色粉末
产物与白色硫酸铜接触
观察现象
试回答:
⑴甲方案中证明有氧化铜的实验现象是_______________________,证明有炭粉的实验现象
是_______________________________________________________。
⑵乙方案中仅有氧化铜的实验现象是___________________________________________。
⑶上两个方案中,你认为哪个方案更好,理由是什么?
_________________________________________________________________________
⑷问题讨论:
经过查阅资料: Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O。
CuSO4+SO2↑+2H2O。
若黑色物质中有Cu,使用甲方案,并将盐酸改为稀硫酸,并加热较长时间,是否可行?
理由是什么?
。
【研究组成】若小宇经实验证明该黑色固体是CuO和C的混合物,则根据上述两个方案,补充相应步骤,以确定其中氧化铜的质量分数,请帮助他完成下表。(该混合物质量已经测定)
| 方案 | 方案中所发生的 化学方程式 | 实验所用仪器 (各缺一件玻璃仪器,填完整) | 实验需要 测定的物理量 |
| 甲 |
| 托盘天平、烧杯、试管、酒精灯、 玻璃棒、 。 |
|
| 乙 |
| 启普发生器(制取氢气)、托盘天平、硬质试管、U型管、玻璃导管、广口瓶、 。 | 反应前U型管及其中硫酸铜总质量及
|
四、计算题(本大题共2小题,计12分)
29.(4 分)医疗上常用的生理盐水是质量分数为0.9%(密度近似为1g/cm3)的氯化钠溶液。500mL的这种生理盐水中含氯化钠__________g。若以每分钟50滴(20滴约为1mL)的速率给病人静脉输液500mL,约需______分钟。
30.(8分)普通黄铜仅由铜和锌组成,广泛用于制造板材、管材等,也用于铸造机械零件。某化学兴趣小组为了测定得到的黄铜样品中铜的含量,称取20g样品研细后放置于烧杯中,加入50g稀硫酸,恰好完全反应后,冷却,称得烧杯的总质量为69.8g。请计算(计算结果精确到0.1%):
(1)此黄铜中铜的质量分数;
(2)所得溶液的溶质质量分数。
盐城第一初级中学2006年初三模拟考试 参考答案
一、选择题(本大题共20小题,每小题2分,计40分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 | C | B | C | B | D | C | D | C | D | B | A | B | C | A | D | C | A | A | C | A |
二、填空题(本大题共6小题,化学方程式每条2分,其余每空1分,计34分)
21.(8分)⑴H2,H2CO3,Fe(OH)3或Fe(OH)2,CO2 , O2, CH4
⑵碳原子排列不同 ⑶不会污染空气
22.(4分)⑴< ⑵甲 ⑶80 ⑷降温结晶
23. (8分)⑴NaOH+HCl=NaCl+H2O(其他合理答案均得分) ⑵Fe2O3+6HCl=2FeCl3+3H2O
⑶Fe+CuSO4=Cu+FeSO4 ⑷CaCO3+2 HCl= CaCl2+H2O+ CO2↑
24.(3分)⑴> ⑵> ⑶>
25.(5分)水 二氧化碳 HCl(或H2SO4)、 Ba(OH)2、 BaCl2(或CaCl2)(其他合理答案均得分)
26.(6分)⑴CaCO3 CaO H2O NaOH
⑵Ca(OH)2+Na2CO3= CaCO3↓+2NaOH
三、实验题(本大题共2小题,计14分)
27.(4分)⑴氧气 ⑵ B ⑶ C或D ⑷ 收集一瓶气体,将带火星的木条伸到集气瓶口
28.(10分)【研究成分】⑴溶液呈现蓝色。溶液底部有黑色物质。⑵白色硫酸铜变蓝且澄清石灰水不变浑浊。⑶甲方案好,因为甲方案装置简单,操作方便。⑷不可行,因为加热较长时间后的稀硫酸变成浓硫酸,铜也能与之反应产生蓝色现象,会干扰CuO的鉴定。
【研究组成】CuO+2HCl=CuCl2+H2O;漏斗;过滤洗涤干燥后的碳的质量。酒精灯,反应后U型管的总质量。
四、计算题(本大题共2小题,计12分)
29.(4分)4.5 200
30.(8分)
解:由质量守恒定律得,反应所生成的氢气为:20g+50g -69.8g =0.2g
(1)设此黄铜中锌的质量为x,反应消耗H2SO4的质量为y,生成ZnSO4的质量为z
Zn +H2SO4=ZnSO4+H2↑
65 98 161 2
![]() x y
z 0.2g
x y
z 0.2g
; ;
解得:x =6.5g y =9.8g z =16.1g
![]() 此黄铜样品中铜的质量为:20g -6.5g =13.5g
此黄铜样品中铜的质量为:20g -6.5g =13.5g
此黄铜样品中铜的质量分数为:
![]() (2)反应后溶液的质量是:69.8g -13.5g =56.3g
(2)反应后溶液的质量是:69.8g -13.5g =56.3g
所得溶液的溶质质量分数为: )
答:此黄铜中铜的质量分数是67.5%,所得溶液的溶质质量分数是28.6%