2005年苏州市初中毕业暨升学考试试卷
化 学
第Ⅰ卷(选择题 30分)
一、选择题(本属包括15小题,每小题2分,共30分。每小题只有一个选项符合题意。)
1.下列关于化学的看法错误的是
A.化学可以为人类研制新材料
B.化学正在环境保护中发挥重要作用
C.化学可以为人类提供新能源
D.化学的发展必然导致生态环境的恶化
2.元素在自然界里分布并不均匀,如智利富藏铜矿,澳大利亚多铁矿,山东的黄金储量居我国首位,但从整个的地壳含量的多少分析,最丰富的金属元素是
A.Fe B.Si C.O D.AL
3.物质都是由微粒构成的,下列物质由分子构成的是
A.干冰 B.碳酸钠 C.金刚石 D.铜
4.下列各物质中,属于合成材料的是
A.陶瓷 B.聚乙烯塑料 C.生铁 D.钢筋混凝上
5.下列实验操作错误的是
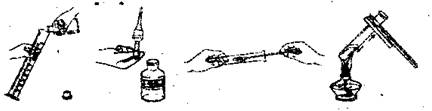
A.向量筒里倾倒液体 B.从滴瓶里取出液体
C.向试管里加入粉末 D.给试管里液体加热
6.铁丝在空气中灼热发红,但不能燃烧,这一事实与下列哪一因素关最密切
A.铁丝的表面积 B.氧气的浓度
C.燃烧区的温度 D.铁的着火点
7.区别以下各组物质的方法错误的是
A.刻划法区别有机玻璃和普通无色玻璃
B.燃烧法区别棉线和羊毛线
C.用酚酞试液区别稀盐酸和氯化钠溶液
D.用肥皂水区别软水和硬水
8.煤矿坑道内”瓦斯”其主要成分是甲烷气体,若不及时通风排除,遇到火星极仪易发生爆炸,甲烷燃烧的化学方程式:![]() 则化学计量数之和等于
则化学计量数之和等于
A.4 B.5 C.6 D.7
9.能简便、粗略地确定某岩石样品中是否含碳酸钙的试剂是
A冰 B.石蕊试液
C.烧碱溶液 D.稀盐酸
10.下列化学肥料属于复合肥的是
A.氯化钾 B.尿素
C.碳酸氢铵 D.硝酸钾
11.下列适量物质溶于水后,可以造成溶液温度显著降低的是
A.硝酸铵 B.蔗糖
C.氯化钠 D.浓硫酸
12.已知20℃硝酸钾的溶解度为31.6g。在该温度下将20g硝酸钾放入50g水中,充分搅拌,则所得溶液中溶质的质量分数约为
A.24.0% B.28.6%
C.31.6% D.40.0%
13.聚乳酸[(C3H4O2)n]是一种对人体无毒无害且可生物降解的理想的高分子环保材料,合成聚乳酸的原料是乳酸(C3H6O3)。下列说法正确的是
A聚乳酸的相对分子质量是72
B.聚乳酸的合成过程属于物理变化
C.乳酸的相对分子质量等于90
D.乳酸充分燃烧的生成物只有CO2
14.以下实验方法不能够达到目的的是
A.用湿润的红色石蕊试纸区别氨气和氯化氢气体
B.用锌粒和浓盐酸两种试剂制取干燥纯净的氢气
C.用高锰酸钾溶液检测二氧化碳气体中是否含有二氧化硫气体
D.向鸡蛋清溶液中加入少量浓硝酸并微热以检验蛋白质的存在
15.下列离子能在pH=13的水溶液中大量共存的是
A.SO42-、Gl-、Na+、H+ B.K+、SO42-、Cu2+、N03-
C.Gl-、K+、SO42-、Na+ D. Ca2+、Gl-、CO32-、Na+
第Ⅱ卷(非选择题 70分)
二、(本题包括4小题,共22分)
16.(4分)用正确的化学符号填空。
(1)1个汞原子 ; (2)2个碳酸分子 ;
(3)3个氢氧根离子 ; (4)硫酸铵 。
17.(4分)人们可以对物质从不同的角度进行分类。请将氢气、一氧化碳、氧化镁、二氧化碳、铝和红磷等六种物质分成二组(填化学式),并写出分类依据。
第一组: ,分类依据是 ;
第二组: ,分类依据是 。
18.(8分)写出下列反应的化学方程式。
(1)用双氧水和二氧化锰制备氧气: ;
(2)纯碱溶液与石灰水反应: ;
(3)三氧化硫与水反应: ;
(4)高温时用一氧化碳还原氧化铁: 。
19.(6分)根据以下实验室常用仪器填空。
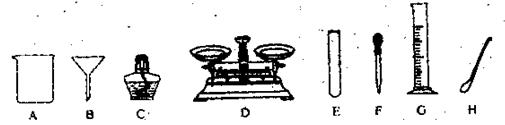
(1)写出指定仪器的名称:C ,E 。
(2)在粗盐提纯实验中,进行 时(填操作名称)用到仪器B;进行蒸发时除了用到铁架台、铁圈和上述提供的仪器外还缺的仪器是 。
(3)配制200g溶质质量分数为0.9%的生理盐水,需要水 g;配制该溶液的整个过程中,需用到上述图示所给的 等仪器(填序号)。
三、(本题包括3小题,共12分)
20.(5分)高铁酸钾(K2Fe04)是具有紫色光泽的微细结晶粉末,它的氧化性超过高锰酸钾,是一种集氧化、吸附、凝聚、杀菌、灭藻的新型、高效的多功能水处理剂。干燥的高铁酸钾在198℃以下是稳定的,受热易分解为氧化铁、金属氧化物和氧气。根据上述信息,请回答下列问题:
(1)高铁酸钾的物理性质是 ;
(2)高铁酸钾中铁元素的化合价为 ;
(3)保存高铁酸钾时应注意 ;
(4)试完成高铁酸钾与水反应的化学方程式。
![]()
21.(4分)β-胡萝卜素(C40H56)是一种天然的植物色素,它广泛存在于黄绿色蔬菜和水果中,一定条件下在人体内它能够转化为维生素A(C20H30O)。
(1)从物质组成的角度,2个维生素A分子可以看作比1个β-胡萝卜素分子多一个 分子;维生素A中碳、氢、氧元素的质量比为 。
(2)黄色胡萝卜中富含β-胡萝卜素,当胡萝卜佐以食用油烹调后,人体对β-胡萝卜素的吸收效率达95%;而生吃胡萝卜吸收β-胡萝卜素仅25%。这说明β-胡萝卜素具有易溶于 的性质。
22.(3分)电动自行车常用的铅蓄电池是一种可充电的化学电源,当给它充电时是 能转化成了 能;太空飞船所用的氢燃料电池是一种将 的装置(填能量形式转化)。
四、(本题包括4小题,共17分)
23.(4分)请用学过的化学知识解释下列生产、生活实际中的一些现象或做法。
(1)冬天建筑施工时往砂浆内掺入氯化钙以防冻。
。
(2)洗洁精易去除餐具上的油污。
。
(3)扑灭森林大火时设置隔离带。
。
(4)切过咸菜的铁质菜刀更容易生锈。
。
24.(4分)某些物质溶于水电离出自由移动的 而使溶液能导电。在氯化钠溶液中存在的微粒是: (填写微粒符号),因为 ___________________________的缘故,所以氯化钠溶液不显电性。
25.(5分)现有A、B、C、D、E、F、G七种物质,C、F是最常见的金属,B是气体单质,D为浅绿色溶液,C为蓝色溶液,它们之间存在如下关系:
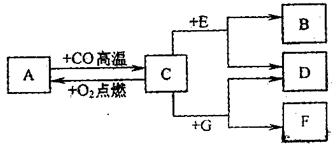
(1)推测下列物质的化学式:B ,D ,F ;
(2) 写出C→A转化的化学方程式: 。26.(4分)煤是一种化石燃料,用煤作燃料生成的SO2气体会造成环境污染。有一种煤每燃烧1t就会释放出53.3kgSO2。如果将产生的SO2用熟石灰来完全吸收,其反应的化学方程式为:S02+Ca(OH)2==CaSO3+H20,那么燃烧5t这种煤产生的SO2在理论上需用多少千克的Ca(OH)2来吸收?(计算结果取整数)
五、(本道包括4小题;共19分)
27.(4分)欲采取化学方法除去下表第I栏内4种物质中的少量杂质(括号内为杂质),请分别从第Ⅱ、Ⅲ栏内选取合理选项的字母序号,填在对应的答案栏内。
| Ⅰ.物质 | Ⅱ.除杂试剂和操作 | Ⅲ.反应类型 | 答 案 |
| ①CuO固体(Cu) | A.高温煅烧 B.氧气,加热 C.盐酸,蒸发 D.铜粉,过滤 | a.置换反应 b.化合反应 c.分解反应 d.复分解反应 | ① |
| ②CaO固体(CaCO3) | ② | ||
| ③Cu(NO3)2 溶液(AgNO3) | ③ | ||
| ④NaCl固体(NaOH) | ④ |
28.(4分)根据以下实验室制备氢气的3个装置图,试填空。
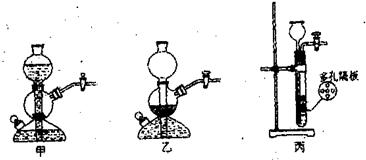
(1)正在产生氢气的装置是 (填序号);收集氢气的方法是
(2)停止产生氢气的装置是 (填序号),这是由于 的缘故(填操作方法)
29.(5分)在一定体积的10%的氢氧化钠溶液中滴加10%的盐酸,反应中溶液的温度与加入盐酸的体积变化如下:

(1)试绘出溶液的温度与加入盐酸的体积之间的变化关系曲线。
(2)根据曲线讨论溶液温度变化的原因。
①加入盐酸的量在2-10mL之间时: ;
②加入盐酸的量在lO-20mL之间时: 。
(3)若某同学提出“将氢氧化钠固体直接与10%盐酸反应,以探究中和反应是否放热”,此提议是否合理?为什么?
答: 。
30.(6分)某校化学兴趣小组的同学经查阅资料知道:淀粉在适当温度和酸催化条件下可转变为葡萄糖。为探究淀粉在不同温度下转化为葡萄糖的程度,他们每人都进行了如下两步实验:
步骤1. 用一支大试管取一定量淀粉与水混合,再加入适量的稀硫酸,摇匀,加热到一定的温度。实验过程中,各人控制温度不同,加热持续时间相同。
步骤2.然后用两支小试管各取少量大试管内的反应混合物,在其中一支小试管(编号为A)内滴加NaOH溶液至呈强碱性,再滴入4-5滴CuS04溶液,并加热至沸;在另一支小试管(编号为B)内滴加2-3滴碘水。观察并记录现象。
(1)由于各人控制的温度不同,出现了下列三种情况。请你根据已学知识,帮助他们完成下列实验情况汇总表。
| 现 象 | 结 论 | |
| 第一种 情 况 | A试管中:____________________________ B试管中:____________________________ | 淀粉没有转化为葡萄糖 |
| 第二种 情 况 | A试管中:____________________________ B试管中:____________________________ | ______________________ |
| 第三种 情 况 | A试管中:____________________________ B试管中:____________________________ | 淀粉全部转化为葡萄糖 |
(2)在步骤2中A试管内所加Na0H溶液的作用是 。
2005年苏州市初中毕业暨升学考试
化学试题参考答案
一、选择题(本题包括15小题,每小题2分,共30分)
1.D 2.D 3.A 4.B 5.B 6.B 7.C 8.C 9.D 10.D 11.A 12.A 13.C 14.B 15.C
二、(本题包括4小题,共22分)
16.(4分)(每空1分)
(1)Hg (2)2H2C03 (3)30H- (4)(NH4)2SO4
17.第一组:H2、Al、P.分类依据:单质
第二组:CO、CO2、MgO 分类依据:化合物(或氧化物)
(写物质名称不给分。按元素组成、化学性质和物理性质等合理因素分类均给分)
18.
(若化学式对,但未配平只给1分;若化学式错,不给分;凡未注明条件的总扣1分)
19.(6分)(每空1分)
(1)酒精灯、试管
(2)过滤,蒸发皿、玻璃棒
(3)198.2 A、D、G、F、H
三、(本题包括3小题,共12分)
20.(1)紫色粉末 (2)+6 (3)防潮避热 (4)3 O2
21.(4分)(每空1分)
(1)2 水 120:15:8(或240:30:16)
(2)油脂
22.(3分)(每空1分) 。
电 化学 化学能直接转化为电能
四、(本题包括4小题,共17分)
23.(1)降低凝固点
(2)洗洁精起乳化作用
(3)可燃物与燃烧区隔离
(4)盐溶液易使铁生锈
24.(4分)
离子H20、Na+、CL-
溶液中各离子所带的正、负电荷总数相等
25.(5分)
(1)(每空1分)B.H2 D.FeS04(或FeCl2) F.Cu
(2)3Fe+202=点燃=Fe304
26.(4分)
需要氢氧化钙308kg。
五、(本题包括4小题,共19分)
27.(4分)(每个正确字母序号0.5分,总得分取整数)
①B、b ②A、c ③D、a ④C、d
28.(4分)
(1)乙、丙;向下排空气法(或排水法)
(2)甲 关闭导气管活塞
29.(5分)
(1)起点、最高点和终点等点表示正确得1分,曲线光滑得1分。
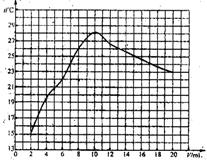
(2)①随盐酸量增加,中和反应放出热量增大,溶液温度上升;
②过量盐酸起冷却降温作用,反应停止热量散失。
(3)不合理,因为固体氢氧化钠溶于水也要放热。
30.(6分)
(1)填表(每格1分,共4分)

(2)(2分)中和稀硫酸、制备氢氧化铜沉淀,使混合液呈碱性。