太原市2006年 初中学业考试
物理化学(化学部分)
可能用到的相对原子质量:H 1 C 12 O 16 Cl 35.5 Ca 40 Zn 65
一、选择题(本大题含14个小题,每小题2分,共28分)在每小题给出的四个选项中,只有一个选项符合题目要求,请选出并在答题卡上将该项涂黑。
1. 人们常喝牛奶是因为牛奶中富含人体所需的
A.铁元素 B.碘元素 C.锌元素 D.钙元素
2. 小明在实验室蒸发某种溶液,他不需要的仪器是
A.玻璃棒 B.蒸发皿 C.酒精灯 D.集气瓶
3.  右图是元素周期表中的一种元素,下列有关该元素的信息正确的是
右图是元素周期表中的一种元素,下列有关该元素的信息正确的是
A.原子序数是 13 B.它是非金属元素
C.原子结构示意图为 D.相对原子质量是13
4. 现有一杯有臭味的水。能除去臭味的方法是
A.搅拌 B.吸附 C.静置 D.过滤
5. 实验室存放氯化镁的试剂瓶标签上的化学式为
A.Mg2Cl B.MgCl C.MgCl2 D.MgCl 3
6. 用你所学的化学知识判断,下列做法正确的是
A.霉变大米清洗后食用 B.水产品经甲醛水溶液浸泡后出售 C.煤气泄漏后立即打开排风扇 D.洗净的铁锅擦干后放在干燥的地方
7. 利用“降温到着火点以下”的原理熄灭蜡烛的是
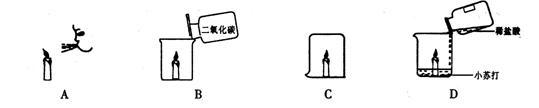
8. 下列反应属于化合反应的是
A.电解水 B.木炭跟氧化铜的反应
C.红磷燃烧 D.实验室用过氧化氢溶液制氧气
9. 化学影响着社会的发展和我们的生活质量。以下认识正确的是
A.硬水过滤后变为软水
B.废旧塑料可采用焚烧的方法处理
 C.农药、化肥会给环境带来污染,因此禁止使用
C.农药、化肥会给环境带来污染,因此禁止使用
D.回收废旧金属既节约金属资源,又减少环境污染
10.右图是某厂生产的葡萄糖酸锌口服液的标签,每支口服液含葡萄糖酸锌45.5 mg,标签“_____”上的数据是
A.3.25 B.6.5 C.13 D.14.3
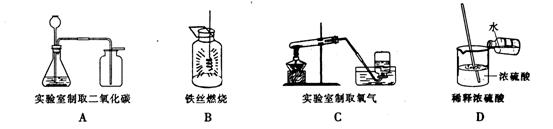
11.下面几种实验装置或操作正确的是
 12.高铁酸钾(K2FeO4)是一种高效多功能水处理剂,它与水反应不可能生成
12.高铁酸钾(K2FeO4)是一种高效多功能水处理剂,它与水反应不可能生成
A.氧气 B.碳酸钾 C.氢氧化钾 D.氢氧化铁
13.下列检验和区分物质的方法正确的是
A.用酚酞溶液检验氢氧化钠是否变质
B.用水区分氯化钠和硝酸铵固体
C.用石蕊溶液检验生石灰中是否混有熟石灰
D.用燃着的木条区分二氧化碳和氮气
14.农业上常用质量分数为16%的氯化钠溶液来选种。下列方法能配制出该选种溶液的是
A.4g氯化钠和16g水 B.16g20%的氯化钠溶液和5g水 C.10g8%的氯化钠溶液蒸发4g水 D.14g10%的氯化钠溶液和1g氯化钠
二、填空题(本大题含4个小题,每空1分,化学方程式2分,共19分。)
15.(4分)用相应的化学符号填空。
水是地球上最重要的溶剂。正常雨水偏酸性,这是因为它溶解了约占空气体积分数0.03%的____________。雨水浸入土壤,溶解了化肥及多种物质,含有____________(填化肥中的一种营养元素)等元素,利于植物吸收。海水中溶解了许多物质,从中可提取___________(填食盐的主要成分)和多种化工产品,同时为海洋生物提供了营养成分。水在人体内形成溶液,输送生命活动所需的各种物质,如对维持体液恒定的pH起重要作用的钠离子和_________(填钾离子)。因此,水对自然界的生命活动有着重大意义。
16.(4分)下面的表格中列出了氯化铵在不同温度下的溶解度:
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| 溶解度/g | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.2 | 60.2 | 65.6 |
(1)从表中可得到的一条信息是___________________________________。
(2)在20℃时,向100g水中加入50g氯化铵,形成氯化铵的______(填“饱和”或“不饱和“)溶液,将其温度升高至60℃时,溶液的质量为________g,该溶液中溶质与溶剂的质量比为______________。
17.(5分)能源是当今世界日益关注的热点之一。
(1)化石燃料是人类获得能量的主要来源,其中的一种是____________,化石燃料燃烧产生的空气污染物中的一种是_______________。从环保角度看,汽油和乙醇相比,较理想的燃料是______________ 。
(2)科学家们不断研发新能源。“神舟六号”栽人飞船的运载火箭所用的高能燃料是偏二甲肼(化学式为C2H8N2),在点燃的条件下,它与N2O4反应生成氮气、水和二氧化碳。该反应的化学方程式为__________________________________。
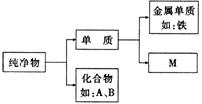 18.(6分)右图表示纯净物中不同物质类别之间的相互关系。A与B
代表不同类别的化合物,且它们的溶液都能与铁反应。
18.(6分)右图表示纯净物中不同物质类别之间的相互关系。A与B
代表不同类别的化合物,且它们的溶液都能与铁反应。
(1) 写出A、B的溶液分别与铁反应的化学方程式。________________________________,_____________________________________。
(2)写出属于“ M ”中两种物质的化学式。要求这两种物质由不同类别的粒子构成。
_______________ _________________
三、实验探究题(本大题含2个小题,每空1分,化学方程式2分,共18分)
19.下图是课堂中模拟炼铁的实验装置。
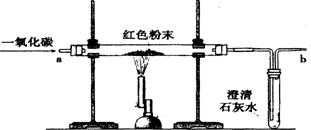
(1)写出图中标有序号的仪器名称① ,② 。
(2)实验过程中,先要进行的是_________________________ 。(填Ⅰ或Ⅱ)
Ⅰ.加热 Ⅱ.通一氧化碳
(3)A中反应的化学方程式是 。
B中反应的化学方程式是 ,B中观察到的现象是________________________。
(4)该装置的不足之处是 。
20.(9分)实验室里某小组正在探究一个问题。根据设计方案,小英向试管中加入2mL氢氧化钠溶液,滴入几滴酚酞溶液,溶液显红色。然后她又用滴管连续滴入一定量的稀硫酸,溶液由红色变为无色。
(1)他们探究的问题是____________(填Ⅰ或Ⅱ)
Ⅰ.酚酞溶液遇酸、碱溶液能显示不同颜色吗?
Ⅱ.酸和碱溶液能发生反应吗?
(2)大家对小英得到的无色溶液继续探究。小斌认为反应后溶液中的溶质是硫酸钠,小亮认为溶质有两种,它们是________________________。同学们根据以下两种方案进行实验后,一致认为小亮的观点是正确的。请你补填下表的空缺。
| 实验操作 | 实验现象 | 实验结论 |
| 方案一:取少许反应后的 溶液置于试管中,向其中加入________ | 小亮的观点正确 | |
| 方案二:取少许反应后的 溶液置于试管中,向其中加入________ |
(3)请你和全组同学一起分析以下问题。
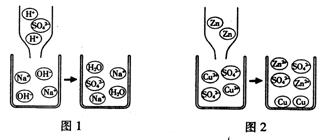
①稀硫酸和氢氧化钠溶液发生反应的微观过程如图1所示。从粒子的角度具体分析该反应能发生的原因是_____________________________________。
②锌和硫酸铜溶液发生反应的微观过程如图2所示。从粒子的角度具体分析该变化是化学变化的原因是____________________________________。
③通过以上分析,揭示出化学反应的微观本质是___________________________。
四、计算题(本大题含1个小题,共5分)
21.(5分)实验室最近购进一批石灰石,交给同学们去测定其中碳酸钙的质量分数。同学们向一定量的样品中加入10%的稀盐酸,一直加到不再产生气泡为止,共用去稀盐酸60g。
(1)计算参加反应的碳酸钙的质量。(计算结果精确到0.1)
(2)同学们无法算出该样品中碳酸钙的质量分数,原因是 __________________________。
参考答案
一、
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 |
| 答案 | D | D | A | B | C | D | A | C | D | B | A | B | B | D |
二、15.CO2 N(或P、K) NaCl K+
16.(1)氯化铵的溶解度随温度升高而增大 (2) 饱和 150 1∶2
17.(1)煤(或石油、天然气)CO(或NO2 、SO2、粉尘。化学式或名称均可) 乙醇(C2H5OH)(2)C2H8N2)+ 2 N2O4 点 燃 3N2+4H2O+2CO2
18.(1)Fe+2HCl==FeCl2+H2↑(或Fe+H2SO4 ==FeSO4+H2↑)
Fe+CuSO4==FeSO4+Cu [或Fe+2AgNO3==2Ag+ Fe(NO3)2]
(2) C (或He等) O2(或H2等)
三、19.(1)铁架台 试管
(2)Ⅱ
(3) Fe2O3+3CO 高温2Fe+3CO2 Ca(OH)2+CO2===CaCO3↓+H2O 澄清的石灰水变浑浊(4)没有尾气处理装置(或没有用燃着的酒精灯处理尾气等)。
20.(1)Ⅱ(2)硫酸钠和硫酸(或Na2SO4 和H2SO4)
(2)
| 实验操作 | 实验现象 | 实验结论 |
| 方案一:取少许反应后的 溶液置于试管中,向其中加入_碳酸钠(或氧化铁) | 产生气泡(或红褐色固体逐渐溶解,溶液由无色变为黄色) | 小亮的观点正确 |
| 方案二:取少许反应后的 溶液置于试管中,向其中加入__锌(或石蕊溶液) | 产生气泡(或溶液显红色) |
(3)①氢离子和氢氧根离子反应生成了水分子
②反应前的锌原子和铜离子变成了锌离子和铜原子
③有新分子或新原子或新离子生成(或产生新粒子)
21.(1)8.2g
(2)没有称量石灰石样品的质量。