中考模拟演练(四)
注意事项:
1.本试题分第I卷和第II卷两部分。第I卷2页为选择题,18分;第II卷4页为非选择题,32分;共50分。考试时间为60分钟。
2.考生答第I卷前务必将自已的姓名、准考证号、考试科目用铅笔涂写在答题卡上,考试结束,试卷和答题卡一并收回。
3.第I卷每题选出答案后,用铅笔把答题卡上对应题目的答案标号涂黑,如需改动,必须用橡皮擦干净后,再选涂其它答案,不能答在试卷上。
第I卷(选择题 共18分)
一、选择题(本题包括12小题,1~6小题每题1分,7~12小题每题2分,共18分。每小题只有一个选项符合题意。)
1.下列变化,属于化学变化的是
A.石蜡熔化 B.纯碱晶体在空气中变为白色粉末
C.瓷碗破碎 D.酒精挥发
2.下列物质中,属于化合物的是
A.胆矾 B.医用酒精 C.生理盐水 D.洁净的空气
3.与元素的化学性质关系最密切的是原子的
A.核外电子层数 B.最外层电子数 C.核内中子数 D.核内质子数
4.下列实验操作正确的是
A.将没有反应完的药品放回原瓶中
B.用酒精灯的焰心给试管中的物质加热
C.用氢气还原氧化铜实验结束时,先停止通氢气,再停止加热
D.固体氢氧化钠需要密封保存是因为氢氧化钠易潮解和易与二氧化碳反应
5.有人认为从DDT农药的发明和应用历史,应得到如下认识,你不赞成的是
A.任何农药都是对人类有害的
B.只有全面、正确了解物质的性质,才合理使用它
C.DDT的滥用导致了环境污染
D.农业应当减少对化学农药的依赖,研制生物农药
6.下列物质中对人体有毒的是
A.乙醇 B.醋酸 C.甲醇 D.氯化钠
7.“绿色化学工艺”是预防污染的基本手段,其理想状态是反应物里的原子全部转化到欲制取的产物中,即原子的利用率为100%。在实际生产过程中,一定属于“绿色化学工艺”的反应类型是
A.分解反应 B.化合反应 C.置换反应 D.复分解反应
8. 只用一种试剂鉴别氢氧化钠、氯化钠、稀硫酸三种溶液,该试剂可以是
A.氯化钡溶液 B.紫色石蕊试液
|
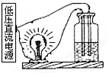
9. 按照右图装置,瓶内盛放下列何种物质时,灯泡发光
A.烧碱固体 B.蔗糖水
C.食盐固体 D.硫酸钠溶液
10.为了增强公民的环保意识,变废为宝,我国的许多城市实行
垃圾分类回收。市区街道的垃圾箱中,绿色箱用来装可回收再利用垃圾,黄色箱用来装不可回收垃圾。以下物质能扔进绿色垃圾箱的是
①废旧报纸 ②废铜线 ③一次性塑料饭盒 ④口香糖 ⑤果皮 ⑥空矿泉水瓶 ⑦废铁锅
A. ①③⑤⑦ B. ③④⑤⑥ C. ①②⑤⑦ D. ①②⑥⑦
11. 下列实验操作正确的是
A.给盛有碱式碳酸铜的试管加热时,试管口应略低于试管底部
B.浓硫酸不慎沾到皮肤上,应立即用氢氧化钠溶液冲洗
C.用托盘天平称量药品时,应将药品直接放在左盘,砝码放在右盘
D.用胶头滴管向试管中添加液体时,应将滴管伸入试管内,以防液体溅出
12.mgKNO3的不饱和溶液,将它恒温下蒸发水分,直到少量晶体析出。在这一变化过程中,溶液中溶质的质量分数(a%)跟时间(t)的变化关系可以用下图表示的是。

第Ⅱ卷(非选择题 共32分)
注意事项:
1.第Ⅱ卷共4页,用钢笔或圆珠笔直接答在试卷上。
2.答卷前将密封线内的项目填写清楚。
| 题 号 | 二 | 三 | 四 | 总 分 |
| 分 数 |
相对原子质量:H 1 C 12 O 16 Al 27 S 32 Cl 35.5 Ca 40 Cu 64
| 得分 | 评卷人 |
|
|
|
二、填空与简答题(本题共包括6小题,共16分)
13.(1分) (1)下列粒子中带正电荷的是 (填序号)。
①电子 ②质子 ③中子 ④原子核 ⑤原子 ⑥分子
(2)空气、生铁、白酒是三种不同的物质,但它们同属于 这一类物质。
14.(2分)近几年我国不少水域多次发生严重的“赤潮”、“水华”现象。“赤潮”、“水华”主要是指水中某些植物营养元素含量过高,导致水面上的藻类疯狂生长、繁殖,水质恶化,造成鱼类死亡。
(1)已知某藻类的化学式为C106H263O110N16P,则组成该藻类的元素有(填元素名称)
种,一个藻类分子中含有原子总数为 个。
(2)由藻类的化学式可以确定工业和生活污水中导致藻类生长过快的营养元素是
(填元素名称)。
(3)为了解决水体污染,应从控制污染源头着手。下列措施①在水域沿岸新建的住宅小区、宾馆、饭店、医院等要采用生活污水净化装置,从根本上解决生活污水排入水域的问题;②沿岸城市居民禁止使用含磷酸钠(Na3PO4)的洗衣粉;③禁止用该水域的水灌溉农田、作为生活用水;④向该水域中加入大量的净水剂和消毒剂以提高水质。能防止“赤潮”、“水华”现象发生的是(填序号) 。
(4)为什么“水华”现象会发生在枯水期,而不会发生在汛期?
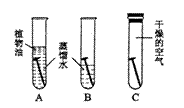 15.(3分)铜锈的主要成分是铜绿〔Cu2(OH)2CO3〕,小明同学为了探究铜在空气中生锈的条件,类比铁生锈条件的探究实验(如右图装置)进行了实验。经过近一月的观察,小明发现B装置中的铜钉生锈了,而A、C装置中的铜钉无明显变化。由此,他得出结论是:“铜生锈的原因是铜与空气中的水和氧气相互作用的结果”。
15.(3分)铜锈的主要成分是铜绿〔Cu2(OH)2CO3〕,小明同学为了探究铜在空气中生锈的条件,类比铁生锈条件的探究实验(如右图装置)进行了实验。经过近一月的观察,小明发现B装置中的铜钉生锈了,而A、C装置中的铜钉无明显变化。由此,他得出结论是:“铜生锈的原因是铜与空气中的水和氧气相互作用的结果”。
 (1)小明所得结论正确中吗? ,
(1)小明所得结论正确中吗? ,
理由: 。
(2)你认为影响铜生锈的因素还可能有 ,为验证你的推测,可选择右图装置,其中①③中所盛的试剂都是氢氧化钠溶液。
作用是: 。
(3)写出铜生锈的化学方程式 。
 16.(3分)(1)煤是一种常用的化石燃料,家庭用煤经过了从“煤球”到“蜂窝煤”的变化,以前人们把煤粉加工成略大于乒乓球的球体,后来人们把煤粉加工成圆柱体,并在圆柱体内打上一些孔(如下图)。请你分析这种变化的优点是:________________
_____。
16.(3分)(1)煤是一种常用的化石燃料,家庭用煤经过了从“煤球”到“蜂窝煤”的变化,以前人们把煤粉加工成略大于乒乓球的球体,后来人们把煤粉加工成圆柱体,并在圆柱体内打上一些孔(如下图)。请你分析这种变化的优点是:________________
_____。
煤在燃烧时会产生许多污染物,为了减少煤燃烧时对环境的污染,可设法把煤转化成清洁的燃料。将水蒸气通过炽热的煤层可制得较洁净的水煤气(主要成分是CO和H2),请你写出该反应的化学方程式____________________。煤气厂常在家用水煤气中特意掺入少量有难闻气味的气体,其目的是______________________。
(2)某同学在实验过程中发现氢氧化钠固体露置在空气中一段时间后,发生了潮解,他在家中也曾发现过饼干受潮会变软。这些现象说明了空气中含有__________。请你结合生活经验或化学知识另举一例说明空气中含有这种物质:____________ _________;
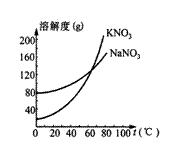
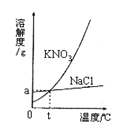 17.(2分)下图为氯化钠和硝酸钾固体的溶解度曲线。根据该图可知:氯化钠的溶解度受温度影响变化不大。此外由该图你还能获得的信息有:
17.(2分)下图为氯化钠和硝酸钾固体的溶解度曲线。根据该图可知:氯化钠的溶解度受温度影响变化不大。此外由该图你还能获得的信息有:
(1)________________________________________;
(2)_________________________________________。
18.(5分)研究性学习小组的同学为了解我省泰山的地质情况,从实地取回两块样品A和B,进行如下图所示的实验(图中部分反应产物被略去)。
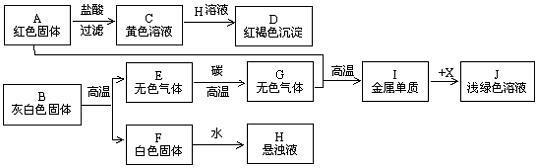
(1)根据所述实验结果,可以推断:样品A、B的主要成分分别是(用化学式表示)___________________、___________________。
(2)写出上述实验过程中部分反应的化学方程式:
①E→G:______________________________。
②C→D:______________________________。
③A+G:______________________________。
(3)所加试剂X可能是氧化物、酸、碱、盐中的_______________。
| 得分 | 评卷人 |
|
|
|
三、实验题(本题包括4小题,共10分)
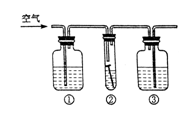
19. (3分)根据下列装置图回答(装置图用序号填空)。
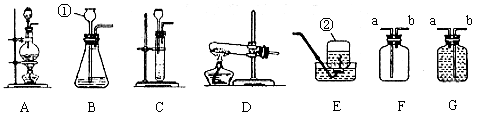
(1)写出编号①、②仪器的名称:①__________,②__________。
(2)实验室用KMnO4制O2时,应选用__________作气体发生装置;实验室制取H2时应选用__________作气体发生装置;已知MnO2固体和浓盐酸混合共热可制得氯气(Cl2),则应选用__________作气体发生装置。
(3)有一位同学欲用F装置收集H2,则H2应从导管口____________通入。
20.(3分)现有三种白色粉末,分别是食盐、白糖和碳酸钙,不能尝味道,也不用水溶解它们,你有什么方法可将其区别开来?(简述实验方法和实验现象)
| 实验操作步骤 | 现象与结论 |
 21.(2分)某学校在实验室搬迁的时候,有两瓶白色固体的标签损坏了,无法辨认。已知其中一瓶是硝酸钾,另一瓶是硝酸钠,实验室的老师把两种固体各称了5g,分别放在两只标号为A、B的烧杯里。请设计实验进行鉴别(右图给出硝酸钠和硝酸钾的溶解度曲线)。
21.(2分)某学校在实验室搬迁的时候,有两瓶白色固体的标签损坏了,无法辨认。已知其中一瓶是硝酸钾,另一瓶是硝酸钠,实验室的老师把两种固体各称了5g,分别放在两只标号为A、B的烧杯里。请设计实验进行鉴别(右图给出硝酸钠和硝酸钾的溶解度曲线)。
22.(2分)实验室中要除去细碎铜屑中的细碎铁屑,某同学设计了两个方案:
(1)加适量稀盐酸然后过滤、洗涤;
(2)加适量硫酸铜溶液然后过滤、洗涤。
两个方案中较好的是(填序号) ,理由是 ;你是否还有更好的方法,若有,请写出来 。
| 得分 | 评卷人 |
|
|
|
四、计算题(本题包括2小题,共6分)
23.(1分)将240g溶质质量分数为15%的硝酸铵溶液分成三等份。在第一份中加入20g水,在第二份中加入20g硝酸铵(溶质又全部溶解),在第三份中蒸发掉20g水,未见有晶体析出。试计算实验后的三份溶液溶质的质量分数分别是 。
24.(5分)某化学研究性小组从古铜器上刮下一些“铜绿”碎屑,为了测定这些碎屑中Cu2(OH)2CO3的含量,该小组称取2.22g碎屑放入烧杯中,然后逐渐加入稀硫酸,微热,发生下列反应:Cu2(OH)2CO3+2H2SO4=2CuSO4+CO2↑+3H2O至恰好完全反应时,用去稀硫酸31.11g,得到不饱和的硫酸铜溶液32g。假设碎屑中的其它物质既不溶于水也不与有关物质反应,试计算:
(1) 碎屑中碱式碳酸铜的质量分数。
(2) 最后得到的硫酸铜溶液中溶质的质量分数。
中考模拟演练(四)
第I卷(选择题 共18分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
| 答案 | B | A | B | D | A | C | B | B | D | D | A | D |
第Ⅱ卷(非选择题 共32分)
13.(1)②、④ (2)混合物
14.(1)5;496 (2)氮、磷 (3)①、② (4) 枯水期,水的流动速度慢,水少,水中营养元素浓度大,故易发生“水华”现象。在汛期,水的流动速度快,水多,水中营养元素浓度小,故不容易发生“水华”现象
15.(1)不正确;没有排除二氧化碳是否参加了化学反应。
(2) 二氧化碳;吸收二氧化碳,证明没有二氧化碳就不能生锈。
(3) 2Cu+O2+CO2+H2O=Cu2(OH)2CO3
16.(1)增大了煤与空气的接触面积,使燃烧更旺,更充分。
C+H2O![]() CO+H2 ;以防止煤气泄漏时能及时发现。
CO+H2 ;以防止煤气泄漏时能及时发现。
(2)水;早上,树叶或小草上有露珠。(其它答案符合题意也可)
17.(1)t℃时KNO3和NaCl的溶解度相等;
(2)KNO3的溶解度随温度的影响,变化较大。
(其它答案符合题意也可)
18.(1)Fe2O3、CaCO3
(2)①C+CO2![]() 2CO ②2FeCl3+3Ca(OH)2 = 2Fe(OH)3↓+3CaCl2
2CO ②2FeCl3+3Ca(OH)2 = 2Fe(OH)3↓+3CaCl2
③Fe2O3+3CO ![]() 2Fe+3CO2
2Fe+3CO2
(3)酸或盐
19.(1)①长颈漏斗,②集气瓶 (2)D;B;A(3)b
20.
| 实验操作步骤 | 现象与结论 |
| 三种白色粉末各取少许,分别在高温下加热。 | 被逐渐炭化变成黑色的是白糖;能分解并有气体产生的是碳酸钙;固体只被融化的是食盐。 |
21.在0℃时把两种固体各5g 分别溶于10mL水中,充分搅拌。能全部溶解的是NaNO3 ;不能全部溶解的是KNO3 。
22.(1);铁屑容易与稀盐酸反应完全,且容易分离。而铁屑与硫酸铜反应时生成的铜附着在铁屑的表面,不能把铁屑全部反应掉。
用磁铁吸引使铁屑与铜屑分离
23.12%、32%、20%
24. (1) 50% (2)5%