2005年河南省高级中学中等学校招生统一考试试卷(非课改)
化 学
一、选择题(每小题只有一个正确答案)
1、下列变化中,属于化学变化的是( )
A.酒精挥发 B.水结成冰 C.钢铁生锈D.空气液化
2、下列各组物质,按化合物、混合物顺序排列的是( )
A.食盐、干冰 B.胆矾、石灰石
C.红磷、烧碱 D.水银、生理盐水
3、下列物质的用途,主要利用物质的物理性质的是( )
A.氢气用于冶炼金属 B.干冰可用以人工降雨
C.氧气供给呼吸 D.石灰石常用于制生石灰
4、下列实验操作的叙述中,正确的是( )
A.实验后剩余的药品,应放回原试剂瓶中
B.氢气还原氧化铜反应完成后,先熄灭酒精灯,继续通入氢气至试管冷却
C.不慎将酸滴在手上,应立即用烧碱溶液擦洗
D.把氢氧化钠固体放在天平左盘滤纸上称量
5、下列有关气体的说法正确的是
A.仅用一盒火柴就可鉴别氢气、氧气、二氧化碳三种气体
B.氢气、氧气、二氧化碳三种气体是无色、无味、密度比空气大的气体
C.一氧化碳、二氧化碳均能与石灰水反应
![]()
 D.氢气、一氧化碳还原氧化铜的反应类型都属于置换反应
D.氢气、一氧化碳还原氧化铜的反应类型都属于置换反应
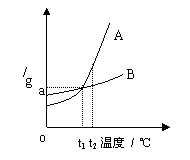
6、右图是A、B两种固体物质的溶解度曲线,下列说法正确的是( )
A.A物质的溶解度大于B物质
B.t1℃时,A、B两种溶液中溶质的质量分数相同
C.t1℃时,两种物质的溶解度都为ag
D.t2℃时的饱和溶液中溶质的质量分数小于B的饱和溶液中溶质的质量分数
7、某气体可能含有H2、N2、CO、CH4中的一种或两种。该气体在足量的氧气中充分燃烧后,将全部生成物依次通过足量的无水硫酸铜和氢氧化钠溶液,发现无水硫酸变蓝色,氢氧化钠溶液的质量增加,则该气体成分不可能是( )
A.CO和CH4 B.H2和CO C.CH4 D.H2和N2
8、我国卫生部规定食盐必须加碘,其中碘以两种化合物形式存在。利用厨房中的食醋、淀粉等可鉴定食盐中是否含碘,其反应原理为5X+KIO3+6CH3COOH=6CH3COOK+3H2O+3I2,试推测X的化学式为( )
A.KI B.K2O C.KIO D.KOH
9、下列四组物质的溶液,不另加其它试剂就可将它们区别开的是( )
A.HCl、H2SO4、NaOH B.CuSO4、NaCl、HCl
C.CaCl2、Na2CO3、K2CO3 D.FeCl3、NaOH、NaCl
10、某探究小组设计了下列四种制备物质的实验方案,其中不能实现的是( )
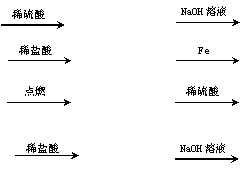 A.Fe2O3
Fe2(SO4)3 溶液
Fe(OH)3
A.Fe2O3
Fe2(SO4)3 溶液
Fe(OH)3
B. CuO CuCl2 Cu
C. Fe Fe2O3 Fe2(SO4)3溶液
D.CaCO3 CO2 Na2CO3溶液
二、填空题
11.生活中的许多问题和我们学过的物质有关。请选用适当的物质填空:能消除冰箱中异味的物质是 ;冬天用煤火取暖,若通风不畅会发生中毒,是由 引起的;各种饮用酒中都含有酒精,其化学式是 。
12.用分子原子的观点解释下列事实:(1)在花园中可以闻到花的芳香: ;(2)用打气筒可将空气压入足球内: ;
13.有下列三组物质:(1)H2、N2、O2、CH4;(2)Na2O、CaO、CO2、CuO;(3)HCl、NaOH、H2SO4、HNO3。按照不同的分类方法,每组中均有一种物质与其他三种类别不同。则每组中不同于其他的物质依次是 、 、 。
14.从给定化合价的Na、Ag、O、N、H、Cl六种元素中,选择适当的元素按要求写出有关物质的化学式:单质 ;含氧酸盐 ;无氧酸 。
15.分别选用一种试剂,用化学方法除去下列物质中的杂质:(1)NaOH溶液中混有少量的Ba(OH)2 ;(2)H2中混有少量的CO2 ;(3)NaCl溶液中混有少量的Na2CO3 。
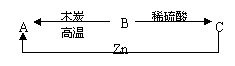 16.A、B、C三种物质之间在一定条件下有如右图所示的转化关系。若A为单质,B为黑色粉末,C的水溶液为蓝色。试推断(用化学式表示):A为 ;B为 ;C为 。
16.A、B、C三种物质之间在一定条件下有如右图所示的转化关系。若A为单质,B为黑色粉末,C的水溶液为蓝色。试推断(用化学式表示):A为 ;B为 ;C为 。
17.室温下,分别把食盐、三氧化硫、生石灰各10g放入盛有100g水的烧杯中,搅拌,充分溶解后静置,依次得到A、B、C三种溶液。所得溶液中溶质质量分数最小的是(用A、B、C表示,下同) 溶液;它们的pH由大到小的顺序是 ;分别取少量溶液,滴加石蕊试液后,显红色的是 溶液。
18.现有Fe、FeO、Fe(OH)3、CuSO4溶液、稀硫酸,若两两混合,可以发生的化学反应
有 个;其中有 个属于置换反应;有 个反应可生成硫酸亚铁。
三、简答题
19.解释下列生产生活中的问题(用化学方程式表示)
(1)不能用铁制容器盛放农药波尔多液。
(2)用石灰浆粉刷过的墙壁,在一段时间内墙壁会“出汗”。
 |
(3)冶金工业上用一氧化碳还原铁矿石里的氧化铁。
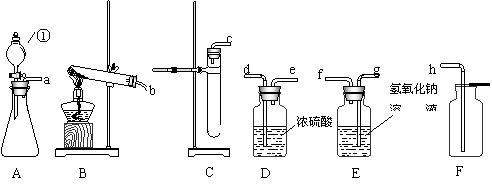
20.下图A、B、C是实验室常用的气体发生装置,装置A中①为分液漏斗,通过分液漏斗活
塞的“开”、“关”,可以向锥形瓶中滴加液体。
请回答下列问题:
(1)请写出在装置B中放入氯酸钾和二氧化锰混合物加热制取氧气的化学方程式。
(2)已知过氧化钠(Na2O2)是一种淡黄色固体,常温下可与水反应生成氢氧化钠和氧气。如果在实验室中用A作气体发生装置,用过氧化钠和水反应来制取一瓶干燥的氧气,所选装置的正确连接顺序是(填写管口字母) 。若只改变A装置中的药品,仍采用已连接的整套装置,还可以用来制取的气体是 。
(3)通过上述两种制取氧气的方法所选用发生装置的对比,可总结出选择气体发生装置应考虑的因素有哪些?
 (4)装置A和C都可以作为实验室制取氢气的发生装置,A和C相比,具有哪些优点?(答出一条即可)
(4)装置A和C都可以作为实验室制取氢气的发生装置,A和C相比,具有哪些优点?(答出一条即可)
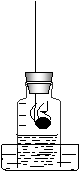
21.右图是测定空气中氧气含量的实验装置。用该装置测定空气中氧气含量时,红磷燃烧结束后,发现钟罩内的水上升到其水面以上容积不足1/5,请推测造成误差的可能原因。(答出两条即可)
22.用盐酸可以清除铁锈(主要成分为Fe2O3),盐酸中主要含有H2O分子、H+、Cl-。某探究小组为探究稀盐酸中的哪种微粒能使氧化铁溶解,设计了如下实验方案,得出了初步结论。
(1)请填写下表中的实验结论:
| 实验过程 | 实验现象 | 实验结论 |
| 向盛有少量Fe2O3的试管 中加入NaCl溶液,振荡 | 固体不溶解 |
(2)是否需要做“向Fe2O3中加入水”的对比实验?为什么?
四、计算题
23.工业上用候氏制碱法制得的纯碱样品中含有一定量的氯化钠。现称取只含有氯化钠杂质的纯碱样品23.3g,放入盛有146g稀盐酸的烧杯中,恰好完全反应。反应后溶液的质量为160.5g。试计算:(1)样品中碳酸钠的质量。(2)所用稀盐酸中溶质的质量分数。
化学试题参考答案及评分标准
一、选择题(每小题1分,共10分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | C | B | B | B | A | C | D | A | D | C |
二、填空题(每空0.5分,共12分)
11.活性炭 CO C2H5OH(或C2H6O)
12.(1)分子不断运动 (2)分子间有间隔
(3)在化学化学变化中,分子可以分成原子(或分子由原子构成)
13.(1)CH4 (2)CO2 (3)NaOH(或HCl)
14.Ag NaNO3 HCl
15.(1)Na2SO4溶液(或Na2CO3溶液) (2)NaOH溶液
(3)稀HCl(或BaCl2溶液等)
16.Cu CuO CuSO4 17. C B<A<C B 18. 4 2 3
三、简答题(本题13分)
19.(3分)
(1)Fe + CuSO4=FeSO4 + Cu (1分)
(2)Ca(OH)2 +CO2=CaCO3↓+ H2O (1分)
(3)Fe2O3 + 3CO高温2Fe + 3CO2 (1分)
20.(5分)
(1) 2KClO3![]() 2KCl+3O2↑ (1分)
2KCl+3O2↑ (1分)
(2)a接d e接h (1分) CO2(1 分)
(3)反应物的状态和反应条件等(1分)
(4)可随时加液体反应物(或通过滴加液体的快慢,控制反应的速率等)(1分)
21.(2分)
红磷的量不足(1分) 装置气密性不好(1分)
22.(3分)
(1)Cl-不能使Fe2O3溶解(1分) H2O分子不能使Fe2O3溶解(1分)
(2)不需要;因为NaCl溶液中含有水,已证明H2O分子不能使Fe2O3溶解(1分)
四、计算题(5分)
23.解:设样品中Na2CO3质量为 x,盐酸中HCl的质量不y
生成CO2的质量为:23.3g+146g-160.9g=8.8g (1分)
Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑ (1分)
106 73 44
x y 8.8g
106: x=44: 8.8g x = 21.2g (1分)
73:y=44:8.8g y= 14.6g (1分)
答:样品中Na2CO3的质量为21.2g,盐酸中溶质的质量分数为10%。