九年级(上)科学月考二试卷
考生须知:
1. 全卷满分为180分,考试时间120分钟。试卷共8页,有4大题,39小题。
2. 本卷答案必须做在答卷的相应位置上,做在试卷上无效。本卷可能用到的相对原子质量:H:1 C:12 O:16 N:14 Na:23 Cu:64 Ca:40 Cl:35.5 Ag:108 Fe:56 S:32 Zn:65 Mg:24
温馨提示:请仔细审题,细心答题,相信你一定会有出色的表现!
一、选择题(每小题4分,共24分,每小题只有一个选项符合题意)
1、为创建浙江省“卫生城市”, 今年市区街道上已出现分类型垃圾收集箱。下图是国家颁布的“城市生活垃圾分类标志”。易拉罐投入的垃圾收集箱上应贴有的标志是( ▲ )

2、下列变化中,属于物理变化的是 ( ▲ )
|
|
|
|




A B C D
3.下列过程中,人对物体做功的是( ▲ )


4、人类最早使用的合金是由铜、锡制成的青铜。明代宋应星在《天工开物》中记载碳还原法炼锡沿用至今,反应的化学方程式为:SnO2+2C![]() Sn+2CO ↑。判断该反应属于(▲ )
Sn+2CO ↑。判断该反应属于(▲ )
(A)化合反应 (B)分解反应 (C)置换反应 (D)复分解反应
5.一般情况下,人体消耗的能量主要来自于下列哪类物质的分解( ▲ )
A.蛋白质 B.无机盐 C.脂肪 D.糖类
6. 下列物质中,一般不能与其他物质发生复分解反应的是( ▲ )
A.HCl B.KN03 C.CaC03 D.NaOH
二、选择题(每小题3分,共48分,每小题只有一个选项符合题意)
7.将混有少量氧化铜粉末的铁粉放入盛有稀硫酸的烧杯中,充分反应后,尚有部分铁剩余,过滤后滤液中含有的溶质是 ( ▲ )
A.FeSO4 B.CuSO4和FeSO4 C.H2SO4 D.H2SO4和FeSO4
8.在人的口腔中,死亡的舌苔表皮和食物残渣在分解时,会产生有臭鸡蛋气味的硫化氢(化学式为H2S )气体,形成口臭。下列关于硫化氢的叙述正确的是( ▲ )
A.硫化氢属于化合物
B.硫化氢气体由三种元素组成
C.硫化氢是氧化物
D.硫化氢分子由一个氢分子和一个硫原子构成
9.锂电池是新型的高能电池,以质量轻、电容量大,颇受手机、手提电脑等用户的青睐。某种锂电池的总反应可表示为Li+MnO2=LiMnO2。以下说法正确的是( ▲ )
①该反应中Mn的化合价发生了变化; ②该反应属于化合反应;
③LiMnO2为新型的氧化物; ④LiMnO2为锂、锰、氧的合金。
A.①② B.①③ C.②③ D.③④
10.现有四种白色固体:① 氯化钠 ② 氯化钡 ③ 无水硫酸铜 ④ 硫酸钠,不使用其它试剂(可以用水)就可以把它们区分开,区分出的先后顺序是( ▲ )
A ②③④① B ②④③① C ③①④② D ③②④①
11、能够证明Fe、Cu、Hg三种金属活动性顺序的一组化学反应是 ( ▲ )
A、Cu + HCl Fe + Hg(NO3)2 Cu + Hg(NO3)2
B、Cu + HCl Fe + HCl Cu + Hg(NO3)2
C、Cu + HCl Fe + HCl Fe + Hg(NO3)2
D、Fe + HCl Fe + Hg(NO3)2 Cu + Hg(NO3)2
12.在一个密闭容器中,有甲、乙、丙、丁四种物质在一定条件下充分反应,测得反应前后各物质质量如下表
| 物质 | 甲 | 乙 | 丙 | 丁 |
| 反应前质量/g | 4 | 2 | 58 | 5 |
| 反应后质量/g | 待测 | 27 | 0 | 19 |
则该密闭容器中发生的化学反应类型为 ( ▲ )
A.分解反应 B.化合反应 C.置换反应 D.复分解反应
13.我们已经知道,物质间的能量是可以转化的。在下列有关能量转化的实例中,说法不正确的是( ▲ )
A.不计空气阻力和摩擦,单摆在上升的过程中,动能转化为势能
B.在核能的和平利用---核电站中,核能直接转化为电能
C.干电池、蓄电池对外供电时,化学能转化为电能
D.植物吸收太阳光进行光合作用时,光能转化为化学能
14.生产自来水时,向水中通入一定量的氯气,这是因为氯气跟水反应,生成盐酸和次氯酸,其中次氯酸具有强氧化性,可以起到消毒灭菌的作用,某学生用这种自来水配制下列物质的溶液,通常不会使药品明显变质的是( ▲ )
A.石蕊试液 B.硝酸银溶液 C.食盐水 D.碳酸钠溶液
15. 在托盘天平的左、右两托盘中各放一只烧杯,调节至平衡,向烧杯分别注入等质量、等质量分数的足量的稀盐酸,然后向两只烧杯中分别加入相同质量的铁和铜镁合金,两烧杯中物质完全反应后,天平仍保持平衡,合金中镁与铜的质量比是( ▲ )
(A) 3:1 (B) 4:3 (C) 3:4 (D) 1:3
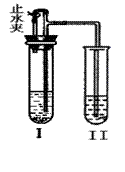 16.亮亮同学曾用如图所示装置进行实验(图中铁架台等仪器均已略去)。在I中加入试剂后,塞紧橡皮塞,立即打开止水夹,Ⅱ中有气泡冒出;一段时间后关闭止水夹,Ⅱ中液面上升,溶液由无色变为浑浊。符合以上实验现象的I和Ⅱ中( ▲ )
16.亮亮同学曾用如图所示装置进行实验(图中铁架台等仪器均已略去)。在I中加入试剂后,塞紧橡皮塞,立即打开止水夹,Ⅱ中有气泡冒出;一段时间后关闭止水夹,Ⅱ中液面上升,溶液由无色变为浑浊。符合以上实验现象的I和Ⅱ中( ▲ )
| A | B | C | D | |
| I | CaCO3.稀HCl | Na2CO3.稀H2SO4 | Zn.稀H2SO4 | Cu.稀H2SO4 |
| Ⅱ | KNO3 | NaCl | BaCl2 | Ba(OH)2 |
17.下列盐可由金属跟酸直接置换反应得到的是( ▲ )
A FeCl3 B Cu(NO3)2 C HgCl2 D MgSO4
18、相同质量的CaCO3、MgCO3、Na2CO3、NaHCO3,分别与足量的盐酸反应,都产生二氧化碳。其中产生的二氧化碳质量相同的是( ▲ )
A、NaHCO3和MgCO3 B、CaCO3和Na2CO3
C、CaCO3和MgCO3 D、Na2CO3和NaHCO3
19.在盛有硝酸银和硝酸镁混合液的试管中,加入一定量的锌粉充分反应,试管底部有固体析出,过滤,向滤液中加稀盐酸,产生白色沉淀。则试管底部析出的固体是( ▲ )
A.镁 B.银 C.锌和银 D.锌和镁
20.现有三种常见胃病药品的标签:

药品中所含的物质均能中和胃里过量的盐酸,上述三种药片中和胃酸多少的比较,正确的是 ( ▲ )
A.①<②<③ B.③<②<① C.①<②<③ D.①<③<②
21.50g镁、锌、铁的混合物与足量的稀硫酸反应得到混合溶液,蒸发后得到218g固体(已换算成无水硫酸盐)。则反应产生氢气的质量是
A.2 g B.3 g C.3.5g D.4.5 g
22.现有a、b、c、d四种无色溶液,分别是碳酸钠溶液、硫酸、氯化钡溶液、盐酸中的一种。根据表有中它们两两间相互反应的实验记录,推断a、b、c、d的顺序正确的是( ▲ )
| a | b | c | d | |
| b | 无明显现象 | —— | 有气体生成 | 有沉淀生成 |
| c | 有气体生成 | 有气体生成 | —— | 有沉淀生成 |
A.H2SO4、Na2CO3、BaCl2、HCl B.HCl、H2SO4、Na2CO3、BaCl2
C.Na2CO3、H2SO4、HCl、BaCl2 D.NaOH、Ca(OH)2、Ba(OH)2
 三、填空题(本大题共40分)请将本卷的答案用钢笔或圆珠笔写在答卷上。
三、填空题(本大题共40分)请将本卷的答案用钢笔或圆珠笔写在答卷上。
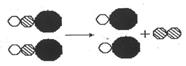
23、有下列四个化学反应:
A.2HgO=2Hg↑+O2↑ B.2H2O=2H2↑+O2↑
C.2HclO=2HCI+O2↑ D.CaCO3=CaO+CO2↑
其中可用如图模型来表示的化学反应是_______▲__________;(填字母代号)
24.实验室有一包白色固体,可能含有无水硫酸铜、硫酸钠、碳酸钠、氯化钡、氯化钾中的一种或几种。现做如下实验:
a.取少量白色固体加足量的水溶解,过滤得白色沉淀和无色溶液。
b.向所得的沉淀中加入足量的稀硝酸,沉淀有部分溶解,并有气体产生,再过滤,滤液无色。
回答下列问题:
(1)仅根据第一步实验现象的描述,你认为白色固体中无水硫酸铜_______▲_______。(选填“存在”、“不存在”或“不能确定”)。
(2)根据两步实验的现象,你认为该白色固体中一定存在的物质是________▲_________,不能确定是否含有的物质是________▲______ ,沉淀有部分溶解的化学反应方程式是________▲_______。
25.痕检是公安机关提取犯罪嫌疑人指纹的一种重要方法,硝酸银显现法就是其中的一种:人的手上有汗迹,用手动用白纸后,手指纹线就留在纸上。如果将硝酸银溶液小心地涂到纸上,硝酸银溶液就跟汗迹中的氯化钠作用,生成氯化银,其反应的化学方程式是___▲__。反应的类型是___▲__反应,氯化银在光照条件下分解生成银粒和另一种单质,其反应的化学方程式是___▲__ 。银粒呈灰褐色,随着反应的进行,银粒逐渐增多,由灰褐色逐渐变成黑色,从而显现出黑色的指纹线。
26.A、B、C、D、E五种物质间的转化关系如下图,其中A为单质,E为红褐色沉淀,则
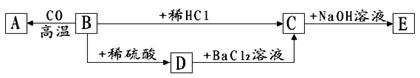
(1)A为 ,C为 (填化学式);
(2)请写出B→D的化学方程式 。
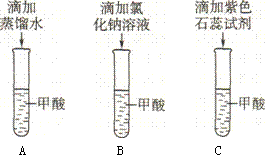 27.甲酸是一种无色、有刺激性气味的液体,有较强的腐蚀性。小明想知道甲酸是否具有酸性,做了如下探究:
27.甲酸是一种无色、有刺激性气味的液体,有较强的腐蚀性。小明想知道甲酸是否具有酸性,做了如下探究:
(1)他作出的猜想是“甲酸具有酸性”。你认为下列哪一项实验设计能够检验这一猜想?请用图中字母表示___▲__。
(2)若小明的猜想是正确的,则甲酸就会像盐酸那样,能与碳酸钠反应,产生______▲__气体。
 (3)甲酸(HCOOH)是有机物,浓硫酸能将有机物中的氢元素和氧元素“脱出”结合成水。利用浓硫酸的脱水性,实验室里将甲酸和浓硫酸混合加热进行反应,该反应中甲酸脱水后会转变成_____▲____ 。
(3)甲酸(HCOOH)是有机物,浓硫酸能将有机物中的氢元素和氧元素“脱出”结合成水。利用浓硫酸的脱水性,实验室里将甲酸和浓硫酸混合加热进行反应,该反应中甲酸脱水后会转变成_____▲____ 。
28.如图所示,用水平力F拉着重为100N的物体,在水平地面上向左匀速移动了5m,物体所受地面的摩擦力大小为20N,则拉力做功_____▲____,重力做功
___▲__。
29、以锌粒、氧化铜、稀硫酸为原料,用两种不同的方法制取铜,写出化学反应方程式。
(1) ▲ ▲ ;
(2) ▲ ▲ 。
四、实验、简答题(本大题共34分)
30、小婧同学在进行酸碱中和反应的实验时,向烧杯中的氢氧化钠溶液滴加稀盐酸一会儿后,又发现忘记了滴加指示剂,因而无法确定盐酸与氢氧化钠是否恰好完全反应。为了证明这两种物质是否恰好完全反应,小婧从烧杯中取了少量反应后的溶液于试管中,并向试管中滴加几滴无色酚酞试液,振荡,观察到酚酞试液不变色。于是她得出“两种物质已恰好完全中和”的结论。
(1)你认为她得出的结论是否正确 ;
(2)写出该中和反应的化学方程式 ;
(3)请你另设计一个实验,探究上述烧杯中的溶液是否恰好完全中和,填写下表:
| 实验方法 | 可能观察到的现象 | 结论 |
| ▲ | ▲ | 中和完,盐酸过量 |
31、维生素C主要存在于蔬菜和水果中,它能促进人体生长发育,增强对疾病的抵抗力。目前药店里有一种“维C泡腾片“的药品能补充人体维生素C的需求。一次小明看到爷爷冲饮这种药品的过程:在一杯温开水中放入一片该药品,药品迅速溶解,同时出现了大量的气泡。小明对这一现象产生了浓厚的兴趣,于是他向爷爷要了几片这种”维C泡腾片“在家中进行实验:在盛有温水的杯中加入该药品,并用燃着的火柴伸到杯口,发现火柴熄灭,由此小明初步推测了该气体中含有的成分,但还不能最终确定。
为了进一步确定自己的推测,第二天小明带着药品去学校实验室做了如下实验:
| 操作 | 感觉气体的色、味 | 气体通入紫色石蕊试液 | 气体通入澄清石灰水 |
| 现象 | 无色、无味 | 紫色石蕊试液变红色 | 澄清石灰水变浑浊 |
(1)分析小明的实验现象,可以确定该气体中一定有 ▲ 。
(2)从该“维C泡腾片”说明书的注意事项中,小明还发现了这样的叙述:冲饮时水温不能高于80oC;冲后即服用。从中你可以推测维生素C还有哪些性质? ▲。(写出一项即可)
32、实验室用过氧化氢(H2O2)制取氧气时常用二氧化锰作催化剂。有同学提出硫酸铜能否代替二氧化锰作该反应的催化剂。下面请你一起参与实验探究,并回答问题:
(1)作出假设:硫酸铜可以作过氧化氢分解反应的催化剂。
(2)实验探究:
实验1:取甲、乙两支试管,分别加入等体积的5%过氧化氢溶液。在甲试管中加入适量的硫酸铜溶液,发现甲试管中迅速产生气泡,在乙试管中加入适量的蒸馏水,观察不到气泡产生。
实验2:取适量实验1中甲试管反应后的溶液,分别装入丙、丁试管中。向丙试管内滴加BaCl2溶液,有白色沉淀产生;向丁试管内滴加NaOH溶液,有蓝色絮状沉淀产生。
(3)分析讨论:
①实验1中设置乙试管起 ▲ 作用。
②实验2中向丙试管内滴加BaCl2溶液产生白色沉淀的化学方程式是 ▲ 。
33.工业上是用氨气还原氧化铜制取铜的。某校化学兴趣小组为探究该反应能否进行并验证其生成物,查阅了大量资料并设计了一系列实验。查阅到的信息:
|
(2)氨气还原氧化铜制取铜的反应原理:2NH3+3CuO===3Cu+N2+3H2O
某小组设计了如下实验装置并进行实验:
氯化铵和熟石灰 氢氧化钠固体
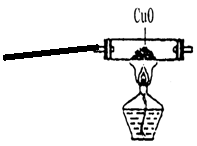 | |||||
 |
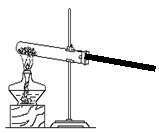 |
试回答:
(1)写出装置A中试管内发生反应的化学方程式:▲ ;
(2)装置B所起的作用是 ▲ ;
(3)装置C中可观察到的实验现象是 ▲ ;
(4)你认为该小组的实验设计还存在着哪些不足? ▲
34.在研讨酸、碱、盐相互间反应关系时,甲、乙两组同学利用碳酸钠溶液按照以下步骤完成实验(假设每步反应都完全)。
 第一步:向碳酸钠溶液中加试剂X,过滤,得白色沉淀;
第一步:向碳酸钠溶液中加试剂X,过滤,得白色沉淀;
第二步:向该沉淀中加试剂Y,沉淀全部溶解,有气体生成,得无色溶液;
第三步:向该溶液中加试剂Z,过滤,最终得不溶于酸的白色沉淀和硝酸镁溶液。
(1)甲、乙两组同学共进行三次实验,其中所选的试剂均不相同,乙组同学最终得到的不溶于酸的白色沉淀不同于甲组。请下表空格中填入相关的化学式:
| 试剂X | 试剂Y | 试剂Z | 最终得到的白色沉淀 | ||
| 甲组 | ① | MgCl2 | HCl | AgNO3 | AgCl |
| 乙组 | ② | BaCl2[或Ba(OH)2] | HNO3 | MgSO4 | ▲ |
| ③ | ▲ | ▲ | ▲ | ||
(2)请写出乙组实验③中碳酸钠溶液与试剂X反应的化学方程式:
▲
五、分析、计算题(本大题共33分)
35.(5分)在科学家的眼里二氧化碳是可以利用的重要资源,只要有合适的条件,可以像发生光合作用那样将二氧化碳转变为所需要的产物。我国科学家陈乾旺等研究成果表明,在440℃和800个大气压条件下,二氧化碳和金属钠反应产生金刚石和碳酸钠,合成的金刚石直径最大可达1.2毫米,完全可以满足工业用途。
(1)二氧化碳与金属钠反应生成金刚石和碳酸钠的化学方程式为: ,
(2)理论上66克二氧化碳可以制得多少克金刚石?
36、(6分)有NaCl和NaNO3的混合物20克,完全溶于水后,向溶液中滴加136克的AgNO3溶液恰好完全反应,有沉淀生成,将沉淀滤出洗涤烘干,干燥后质量为28.7克。求:
(1)原混合物中NaCl的质量分数;
(2)反应后,滤液中溶质的质量分数是多少?
37. (6分)铜粉和铁粉的混合物20克,加入足量的20%的硫酸溶液,待完全反应后,得到氢气0.2克,问: (1)混合物中铁为多少克?
(2)要使混合物中的铁完全反应,至少需20%的硫酸溶液多少克?
38.(6分)横亘在我市老余杭、山沟沟、山脉的岩石以石灰岩为主,石灰石储量达50亿吨,是我市制造水泥、石灰、轻质碳酸钙的主要原料来源。某校科学探究小组同学把一块从超山捡来的石灰石做纯度分析,进行了如下实验:
①用天平准确称取20克石灰石放入甲图A装置中,同时加入足量稀盐酸;
②测量C装置中吸收到的由反应过程中产生的二氧化碳的质量,并据此绘成乙图中的曲线;
③根据实验结果计算该石灰石的纯度。
请分析回答下列问题:
 |
⑴甲图中装置B的作用是 ▲ 。
⑵根据实验数据计算该石灰石中CaCO3的质量分数。
⑶忽略空气中二氧化碳及盐酸挥发对实验结果的影响,你认为由C装置测得的二氧化碳质量与反应产生的二氧化碳质量相等吗?试分析原因。 ▲ 。
39.(10分)为了测定由NaCl和Na2SO4所组成的混合物中Na2SO4的质量分数,某同学的实验步骤如下:①称取a克样品,加水溶解;②加入过量的试剂A;③将所得的沉淀过滤、洗涤、干燥;④称量所得沉淀的质量为b克。请回答下列问题:
(1)所选择的试剂A最好是(请从下列选项中选择) ;
a.AgNO3 b.BaCl2 c.CaCl2
(2)试剂A必须过量,以保证反应物完全沉淀,简述应如何判断试剂A是否过量 ;
(3)若未洗涤沉淀,则测量的结果将会 (填偏高、偏低或不变);
洗涤沉淀的方法是(请从下列选项中选择) ;
a.将滤纸上的沉淀转移至烧杯中,加水后用玻璃棒充分搅拌,然后再次过滤;
b.直接在过滤器中加水淋洗,并用玻璃棒不断搅拌;
c.直接在过滤器中加水淋洗,但不能用玻璃棒搅拌;
(4)样品中Na2SO4的质量分数为 (用含a、b的代数式表示,可不化简)。
可能用到的式量:NaCl—58.5 Na2SO4—142 AgCl—143.5 BaSO4—233 CaSO4—136