第一章:探索物质的变化单元测试
一、选择题(本题共有20小题,每小题2分,共40分。每小题只有一个选项是正确的。)
1、日常生活中发生的下列变化,属于化学变化的是 ( )
A、酒精挥发 B、火柴燃烧 C、冰雪消融 D、铁块形变
2、下列物质与盐酸反应可以得到无色透明溶液的是 ( )
A.铝 B.氧化铁 C.氢氧化铜 D.硝酸银
3、下列各种物质的名称或俗称和化学式表示的是同一种物质的 ( )
A.熟石灰,消石灰,CaO B.火碱,烧碱,NaOH
C.铁锈,氢氧化铁,Fe(OH)3 D.生石灰,石灰水,Ca(OH)2
4、光导纤维是将二氧化硅在高温下熔化、拉制成粗细均匀的光纤细丝,是信息高速公路的基础材料,在通讯、医疗、科技等领域都有广泛应用。二氧化硅(SiO2)属于( )
A、氧化物 B、酸 C、碱 D、盐
5、固体氢氧化钠可用作干燥剂,下列气体不能用它干燥的是 ( )
A、一氧化碳 B、二氧化碳 C、氧气 D、氮气
6、现有X、Y、Z三种金属,把X、Y分别插人Z的硝酸盐溶液中,X无反应,Y表面上析出Z。判断这三种金属活动性由强到弱的顺序是 ( )
A.Y Z X B. Y X Z C. X Y Z D.X Z Y
7、双氧水是过氧化氢(H2O2)的水溶液,常用于消毒、漂白等。实验室也常用它来制取氧气,化学方程式为2H2O2 MnO2
2H2O![]() ,该化学反应的类型属于
( )
,该化学反应的类型属于
( )
A.化合反应 B.置换反应 C.分解反应 D.复分解反应
8、 “NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl”是著名的“侯氏制碱法”的重要反应。
下面是4位同学对该反应涉及的有关知识发表的部分见解。
其中不正确的是 ( )
 | |||
 | |||





![]()
A B C D
9、小玲猜测一瓶久置于空气中的NaOH溶液中含有Na2CO3,她设计的下列实验能对此猜测提供有力实证的是 ( )
A、滴加CuSO4溶液 B、滴加稀盐酸 C、滴加酚酞试液 D、滴加石蕊试液
10、下列各组物质在水溶液中能大量共存的是---------------------------( )
A、 AgNO3,NaCl B、Na2SO4,MgCl2 C、 HCl,Na2CO3 D、 MgCl2,K2CO3
11、下列各组金属的活动性符合由强到弱的顺序的是 ( )
A、Mg Fe Zn Cu B、Mg Zn Fe Cu
C、Cu Fe Zn Mg D、Zn Mg Fe Cu
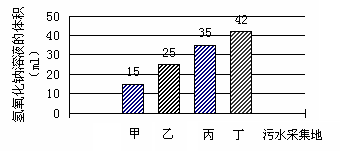 12、某中学科学兴趣小组,为测定学校附近河水被工厂排放的废水所污染的程度,分别在甲、乙、丙、丁四个点收集到河水均为400 ml,用固定质量分数的NaOH溶液进行中和,并得到如右图所示NaOH溶液消耗量。据此判断这四个点中,河水酸化最严重的是
(
)
12、某中学科学兴趣小组,为测定学校附近河水被工厂排放的废水所污染的程度,分别在甲、乙、丙、丁四个点收集到河水均为400 ml,用固定质量分数的NaOH溶液进行中和,并得到如右图所示NaOH溶液消耗量。据此判断这四个点中,河水酸化最严重的是
(
)
A、甲 B、乙
C、丙 D、丁
13、某同学为了确定Fe、Cu、Hg三种金属的活动性顺序,用铁片、铜片、硝酸汞溶液和盐酸四种试剂设计了下列实验方案,其中可行的是 ( )
A.Fe+HCl Cu+HCl Fe+Hg(NO3)2 B.Fe+HCl Fe+Hg(NO3)2 Cu+Hg(NO3)2
C.Fe+HCl Cu+HCl Cu+Hg(NO3)2 D.Cu+HCl Fe+Hg(NO3)2 Cu+Hg(NO3)2
14、只用一种试剂来鉴别氢氧化钠、氢氧化钙和稀盐酸三种溶液,这试剂是 ( )
A、氯化钡溶液 B、碳酸钠溶液 C、酚酞试液 D、硝酸银溶液
15、能与酸反应生成盐和水的氧化物是 ( )
A. H2O B. KOH C. CO2 D.ZnO
16、以下四种溶液:①MgSO4 ②NaOH ③CuSO4 ④KCl。若不用其他试剂,但可以用被鉴别出来的物质,则被鉴别出来的先后顺序是 ( )
A②①③④ B③②①④ C③④②① D①②③④
17、下列物质中,属于氮肥的是 ( )
A 硝酸铵 B 磷酸钾 C 硫酸钾 D 磷酸二氢钙
18、下列物质可以由相应的金属和酸发生置换反应而制得的是 ( )
A、Fe2(SO4)3 B、CuCl2 C、AgNO3 D、Al2(SO4)3
19、小冬在自制酸碱指示剂的探究活动中记录如下,由下表判断,不能做指
示剂的是( )
| 植物的汁液 | 在酸性溶液中 | 在中性溶液中 | 在碱性溶液中 | |
| A | 牵牛花瓣 | 红色 | 紫色 | 蓝色 |
| B | 胡罗卜 | 橙色 | 橙色 | 橙色 |
| C | 紫罗卜皮 | 红色 | 紫色 | 黄绿色 |
| D | 月季花瓣 | 浅红色 | 红色 | 黄色 |
20、已知某无色溶液中含有稀硫酸,则该溶液中还可能含有的物质是-------------( )
A、CuSO4 B、BaCl2 C、ZnSO4 D、Cu(OH)2
二、简答题(每空1分,化学方程式2分,共40分)
21、现有盐酸、氢氧化钠,碳酸钠、氢氧化钙,大理石五种物质,请用它们的化学式填写以下空格:
(1)可用于除锈的是 ; (2)属于可溶性盐的是 ;
(3)可用来降低土壤酸性的是 。
22、酸碱反应与人们的日常生活和生产有密切的关系。
⑴由于人的胃里有_________,因此胃液分泌过多会引起胃病,服用含有氢氧化铝的药物可缓解病痛。其治疗的化学原理为(用化学方程式表示)_____ ___________________。
⑵ 做馒头发酵面团时,会产生乳酸等有机酸,蒸馒头前需加进适量的纯碱或小苏打等碱性物质,它们相互作用产生了__________气体(填化学式),使蒸出的馒头疏松多孔;若加入的碱性物质过多,可向面团或蒸锅中滴加少许含____________(填名称)的酸性调味料,否则蒸出的馒头会变涩,颜色发黄。
23、请根据下表回答有关问题。(除第(2)小题外,其余均用序号填写)
| 序号 | ① | ② | ③ | ④ |
| 物质 | 醋酸 | 高锰酸钾 | 熟石灰 | 纯碱 |
| 化学式 | CH3COOH | KMnO4 | Ca(OH)2 | Na2CO3 |
⑴上表中的物质属于碱的是 。
⑵用表中的物质作为反应物,写出制取氢氧化钠的化学方程式:
⑶若要测定纯碱溶液的酸碱度,可选用下列选项中 。
①无色酚酞试液 ②紫色石蕊试液 ③pH试纸
⑷槟榔芋皮上含有一种碱性的物质—皂角素,皮肤沾上它会奇痒难忍,你认为可选用下
列 来涂抹止痒。
①食醋(含醋酸) ②熟石灰 ③纯碱
24、向盛有石灰水的试管中加入饱和碳酸钠溶液,观察到的现象为 ,向试管中滴入酚酞,溶液为 色,再加入过量的盐酸,观察到的现象为 。
25、今有AgNO3溶液、BaCl2溶液、Ba(NO3)2溶液、Ba(OH)2溶液、Na2CO3溶液和Zn粉供选用。
(1)若欲除去稀硝酸中混有的少量硫酸,以得到纯净的稀硝酸,应加入适量 ,发生反应的化学方程式为
(2)若欲除去氯化钠溶液中混有的少量盐酸,以得到纯净的氯化钠溶液,应加入适量 ,发生反应的化学方程式为 ,该反应的类型是 。
|
| OH- | NO3- | Cl- | CO32- | SO42- |
| H+ | - | 溶、挥 | 溶、挥 | 溶、挥 | 溶 |
| Na+ | 溶 | 溶 | 溶 | 溶 | 溶 |
| Ca2+ | 微 | 溶 | 溶 | 不 | 微 |
| Ba2+ | 溶 | 溶 | 溶 | 不 | 不 |
| Cu2+ | 不 | 溶 | 溶 | 不 | 溶 |
26、酸、碱、盐溶解性表是学习自然科学的重要工具。右表列出了“部分酸、碱、盐在20℃时的溶解性”。请你利用此表完成以下任务:
(1)查:Ba(OH)2的溶解性_________。
(2)写化学式:一种不溶于水的盐_________。
(3)判断:氯化钠溶液与硝酸钙溶液能否发生反应及其理由是________ _。
27、沼气和天然气的主要成分是______________,是最简单的有机物。写出它燃烧的化学方程式:_____________________________________________________。
28、铁锈的主要成分是 (写分子式),将生锈的铁钉投入过量的稀硫酸中,首先看到铁锈溶解,溶液呈 色,反应的化学方程式为 ;过一会儿,又看到有气泡产生,这是因为(用化学方程式表示) 。
29、利用科学原理可以进行一些有趣的小魔术。
(1)白花变红花。在白的纸花上,先喷上无色的A溶液,再喷上无色的B溶液,白花立即变成了红花。如果A溶液是无色酚酞,则B是 (填序号:①稀盐酸②氢氧化钠溶液③食盐水)。
(2)“清水”变“牛奶”。在无色液体C中,倒入无色液体B,立,即产生“牛奶”般的白色沉淀。如果C是稀硫酸,则B是 (填序号:①氢氧化钠溶液②氯化钡溶液③氯化钠溶液)。
30、沼气和天然气的主要成分是______________,是最简单的有机物。写出它燃烧的化学方程式:_________________________。
三、实验探究题(每空2分,共10分)
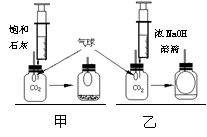 31、【发现问题】研究性学习小组中的小张同学在学习中发现:通常检验CO2用饱和石灰水,吸收CO2 用浓NaOH溶液。
31、【发现问题】研究性学习小组中的小张同学在学习中发现:通常检验CO2用饱和石灰水,吸收CO2 用浓NaOH溶液。
【实验探究】在体积相同盛满CO2 的两集气瓶中,分别加入等体积的饱和石灰水和浓NaOH 溶液。
实验装置和现象如图所示。请你一起参与。
【现象结论】甲装置中产生的实验现象(用化学方程式表示) ,解释通常用石灰水而不用NaOH 溶液检验CO2的原因 ;
乙装置中的实验现象是 ,吸收CO2较多的装置是 。
【计算验证】小李同学通过计算发现,等质量Ca(OH)2和NaOH吸收CO2的质量,Ca(OH)2大于NaOH。因此,他认为吸收CO2 应该用饱和石灰水。
【思考评价】请你对小李同学的结论进行评价:
四、分析计算题(10分)
32、现有碳酸钠和氢氧化钠组成的固体混合物9.3克与50克稀盐酸恰好完全反应,产生二氧化碳2.2克,求:(1)原固体混合物中碳酸钠的质量;
(2)原固体混合物中氢氧化钠的质量分数。 (3)原稀盐酸的质量分数。