选择题训练(45)
一、选择题(每小题只有一个正确答案,每小题4分,8小题共32分)
1.实验室的钠着火燃烧时,可用下列哪种物质灭火
A.水 B.沙土 C.泡沫灭火器 D.干粉灭火器
2.下列物质均为化合物的一组是
A.金刚石、干冰、S02 B.KCI、盐酸、NaOH
C.CuS04·5H20、冰、乙醇 D.臭氧、CaC03、铝合金
3.用98%(质量分数)的浓硫酸来配制一定体积的1.0mol·L-1的稀硫酸时,下列仪器不需要用到的是
A.玻璃棒 B.胶头滴管 C.托盘天平 D.容量瓶
4.把少量氢氧化钠固体分别加入到100mL的下列溶液中,溶液的导电能力变化最小的是
A.盐酸溶液 B.自来水 c.醋酸溶液 D.氯化钾溶液
5.“纳米材料”(1nm=10-9m)已广泛应用于催化及军事科学中。“纳米材料”是指研究开发直径为几纳米至几十纳米的材料,如将“纳米材料”分散到液体分散剂中。有以下叙
述:①所得物质一定是溶液,②能全部透过半透膜,③有丁达尔现象,④所得液体可以全部透过滤纸。对所得分散系的上述叙述正确的是
A.①② B.②③ c.①④ D.③④
6.碱金属元素随核电荷数增加,下列各项中跟卤族元素变化不一致的是
A.单质的熔沸点 B.单质的密度
C.原子的电子层数 D.原子半径
7.根据等电子原理:由短周期元素组成的微粒,只要其原子数相同,各原子最外层电子萎层之和也相同,可互称为等电子体,它们具有相似的结构特征。以下各组微粒结构不相{的是
A.CO和N2 B.03和S03 C.C02和N20 D.N2H4和C2H4
![]() 8.从松树中分离出松柏醇,其结构简式如右图:下列叙述正确的是
8.从松树中分离出松柏醇,其结构简式如右图:下列叙述正确的是
A.它难溶于水,也不溶于有机溶剂
B.它不溶于NaHCo3溶液,但可与NaOH溶液发生中和反应
C.I mol该化合物最多能与4molH:发生加成反应
D.1mol该化合物在溴水中最多能与4molBr2发生加成反应
二、选择题(每小题4分,10小题共40分,每小题有一个或两个正确选项。)
9.用NA表示阿伏加德罗常数,下列说法正确的是
A.标准状况下,11.2L氦气所含的原子数目为NA
B.由2H和18O所组成的水llg,其中所含的中子数为4NA
C.1.6gN![]() 离子中所含的电子数为NA
离子中所含的电子数为NA
D.2LO.3mol/L的硫酸铝溶液中所含硫酸根离子数目为1.8 NA
10.下列数据是对应物质的熔点:
| 物质 | Na2O | NaCl | AIF3 | A1C13 | BCl3 | A1203 | C02 | SiO2 |
| 熔点 | 920 | 801 | 1291 | 190 | -107 | 2073 | -57 | 1723 |
由以上数据做出的下列判断,其中错误的是
A 铝的化合物的晶体中有的是离子晶体
B 表中只有BCl3和干冰是分子晶体
C.同族元素的氧化物可形成不同类型的晶体
D.不同族元素的氧化物可形成相同类型的晶体
11.Na3N是离子化合物,它能与水反应生成氨气。以下关于Na3N的说法中正确的是
A.Na3N与盐酸反应时生成一种盐 B.Na3N分子中Na+的半径比N3-的半径小
 C.在Na3N与水反应中Na3N是还原剂 D.Na+与N3-的电子层都与氩原子的结构相同
C.在Na3N与水反应中Na3N是还原剂 D.Na+与N3-的电子层都与氩原子的结构相同
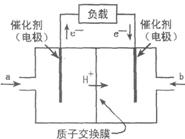
12.右图是2004年批量生产的笔记本电脑所用甲醇燃料电池的结构示意图。甲醇在催化剂作用下提供质子(H+)和电子,电子经外电路、质子经内电路到达另
一极与氧气反应,电池总反应为:2CH30H+302=====2CO2+4H20
下列说法正确的是
A.右电极为电池的正极,b处通人的物质是空气
B.左电极为电池的负极,a处通入的物质是空气
C.负极反应式为:CH30H+H2O一6e-=====C02+6H+
D.正极反应式为:O2+4e-====202-
![]() 13.在容积不变的密闭容器中存在如下反应:
13.在容积不变的密闭容器中存在如下反应:
某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是
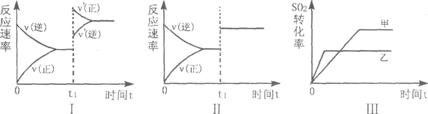
A.图I表示的是t1时刻增大O2的浓度对反应速率的影响
B.图Ⅱ表示的是t1时刻加入催化剂后对反应速率的影响
C.图Ⅲ表示的是催化剂对平衡的影响,且甲的催化效率比乙高
D.图Ⅲ表示的是温度对化学平衡的影响,且乙的温度较高
14.下列事实,不能用勒夏特列原理解释的是
A.溴水中有平衡:![]()
![]() HBr+
HBrO,当加入AgNO3溶液后,溶液颜色变浅
HBr+
HBrO,当加入AgNO3溶液后,溶液颜色变浅
B.对2HI(g) ![]() H2(g)+I2(g),平衡体系增大压强可使颜色变深
H2(g)+I2(g),平衡体系增大压强可使颜色变深
C.反应CO+NO2![]() CO2+NO;△H<O。升高温度可使平衡向逆反应方向移动
CO2+NO;△H<O。升高温度可使平衡向逆反应方向移动
D.合成NH,反应,为提高NH,的产率,理论上应采取相对较低温度的措施
15.下列反应的离子方程式中不正确的是
A 氨气通人甲酸溶液中:HCOOH+NH3====HCOO- + NH4+
B 用碳棒作电极电解氯化钠饱和溶液:2C1-+2H20
![]() 20H-+C12 ↑+H2↑
20H-+C12 ↑+H2↑
C.过量二氧化碳通人偏铝酸钠溶液中:CO2+2H20+A102-=Al(OH)3 ↓+HC03-
D.用氨水吸收少量二氧化硫:NH3·H20+S02====NH4++HSO3-
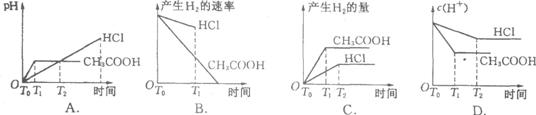
16.在体积都为1L,pH都等于2的盐酸和醋酸溶液中,投入0.65g锌粒,则下图所示比较符合客观事实的是 C
17.已知酸式盐NaHB在水溶液中存在下列反应:①NaHB====Na++HB-,②HB-![]() H++B2-,③HB-+H20
H++B2-,③HB-+H20![]() H2B+OH-且溶液中c(H+)>c(OH-),则下列说法一定正确的是
H2B+OH-且溶液中c(H+)>c(OH-),则下列说法一定正确的是
A.NaHB为强电鳃质 B.H:B为强酸 ,
C.H2B为弱电解质 D.HB-的电离程度小于HB-的水解程度
18.已知KHS03溶液呈弱酸性。在0.1mol·L-1KHSO,溶液中,下列关系正确的是
A.C(K+)+c(H+)=C(HS03-)+C(OH-)+C(S032-)
B.c(HS03-)+c(S032-)=0.1mol·L-1
C.c(S032-)>c(H2S03)
D.c(K+)=c(H2S03)+c(HS03-)+c(s032-)