高中毕业班化学综合测试(二)
本试卷分为第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,共150分,考试时间120分钟。
第Ⅰ卷(选择题共70分)
可能用到的相对原子质量:H—1 C—12 O—16 Na—23 Mg—24 Cl—35.5 Ca—40
一.选择题(本题包括10小题,每小题3分,共30分。每小题只有一个选项符合题意。)
1.某同学尝试用所学的化学知识解释或解决生活中出现的现象和问题,下列解释或方案中合理的是
①利用强弱电解质的导电实验可鉴别纯净水和矿泉水
②打开汽水瓶盖时有大量气泡涌出,可用列夏特勒原理解释
③铁制自来水管与铜制水龙头连接时铁水管锈蚀更快,是因为形成原电池的缘故
④禽流感是一种传染病,高温蒸煮能够杀灭禽流感病毒。
A.①③ B.③④ C.①② D.全部
2.下列各组化合物中,均能由单质直接化合而得到的是
A.NH3、CuS、SO2、CuCl2 B.FeCl3、SO2、NO、Cu2S
C.SO3、Cu2S、NO、FeCl3 D.FeCl2 、FeS、SO2、NH3
3.依据物质的相关数据,可以推断物质的结构和性质。下列利用物质的相关数据作出的相应推断不合理的是
A.根据气体的相对分子质量,可以比较两种气体在同温同压下密度的大小
B.根据甲烷和乙烷的熔点,可以比较二者晶体中的分子间作用力的大小
C.根据液体密度的大小,可以判断液体的挥发性的强弱
D.根据同周期金属元素原子半径的大小,可以比较同周期元素的金属性强弱
4.目前,人类已经发现的非金属元素除稀有气体元素外共16种。下列对这16种非金属元素的判断正确的有 ①都是主族元素,最外层电子数都大于3 ②单质形成的晶体都为分子晶体③氢化物常温下都是气态,所以又叫做气态氢化物 ④氧化物常温下都可以与水反应生成酸
A.只有①②正确 B.只有①③正确
C.只有③④正确 D.①~④都不正确
5. 某混合气体G可能含有CO、CO2、SO2、H2O等气体,用a.无水CuSO4、b.澄清石灰水、c.灼热CuO、d.碱石灰、e.酸性品红溶液、f.酸性高锰酸钾溶液等药品可将其一一检出,检出的正确顺序是
A.G→a→e→b→f→d→c B.G→c→d→b→e→f→a
C.G→a→e→f→b→d→c D.G→b→e→f→a→d→c
6.下列关于工业生产的叙述中,错误的是
A.采用电解熔融氯化铝的方法制取金属铝
B.目前合成氨,没有采用更高温度、更大压强是从设备和动力要求方面考虑的
C.用离子交换膜法电解饱和食盐水制烧碱
D.生产硫酸时,接触室内热交换器的作用是预热进入的炉气和冷却反应生成的气体
7.关于下列各装置图的叙述中,正确的是 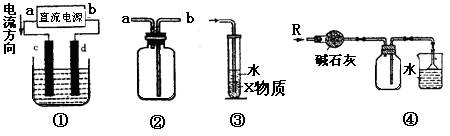
A.装置①中,c为负极,d为正极
B.装置②可用于收集H2、NH3、Cl2、HCl、NO2、N2等
C.装置③中X为苯,可用于吸收氨气或氯化氢
D.装置④可用于干燥、收集氨气,并吸收多余的氨气
8.分别向pH=1的某酸溶液和pH=13的NaOH溶液加入足量的铝片,放出氢气的物质的量之比为3:1,其原因可能是
①两溶液的体积相同,酸是多元弱酸
②两溶液体积相同,酸是弱酸
③酸溶液的体积是NaOH 溶液体积的9倍
④酸是强酸,且酸溶液的浓度比NaOH溶液浓度大
A.只有①和④ B.只有②和④
B.只有①和③ D.只有②和③
9.下列结论正确的是
①微粒半径:Fe(OH)3胶粒>S2->Cl>S>F ②氢化物稳定性:HF>HCl>H2S>H2Se
③离子还原性: Fe3+>Cu2+>Fe2+>Zn2+ ④单质氧化性:Cl2>S>Se>Te
⑤酸性:H2SO4>HClO4>H2SeO4 ⑥熔沸点:Na>H2O>HF>HCl
A. ①②④ B. ②④⑥
C. 只有① D. 只有⑥
10.用NA表示阿伏加德罗常数的值,下列说法正确的是
A.1L水中所含的H+数目为10-7×NA
B.7.8gNa2O2与足量水充分反应转移电子数为0.2NA
C.26.75gNH4Cl中含有的共用电子对数为2NA
D.同温同压下,体积均为11.2L的CO2和SO2所含有氧原子数为NA
二、选择题(本题包括10小题,每小题4分,共40分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为O分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该小题就为O分。)
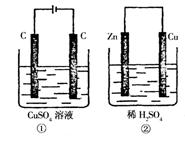 11.如图所示的两个实验装置中,溶液的体积均为200mL,开始时电解质溶液的浓度均为0.1mol·L-1,工作一段时间后,测得导线中均通过0.02mol电子,若不考虑盐的水解和溶液体积的变化,则下列叙述中正确的是
11.如图所示的两个实验装置中,溶液的体积均为200mL,开始时电解质溶液的浓度均为0.1mol·L-1,工作一段时间后,测得导线中均通过0.02mol电子,若不考虑盐的水解和溶液体积的变化,则下列叙述中正确的是
A.产生气体的体积:①>②
B.电极上析出物质的质量:①>②
C.溶液的pH变化:①增大,②减小
D.电极反应式:①中阳极 4OH--4e-=2H2O+O2↑;②中负极:2H++2e-=H2↑
12.将CH3COOCH=CH2与CH2=C(CH3)COOCH3加聚,再经过适当的反应即可制得强吸水性的高分子化合物X,X吸水后的质量可达其自身质量的数百倍。高分子X已被广泛用于卫生用品和农业上作吸水剂。下列关于X的说法中正确的是
![]()
A、X分子中含 B、制取X的过程中有小分子生成
C、熔化的X与钠反应可生成氢气 D、上述适当的反应类型为加聚反应
13.下列离子在溶液中能大量共存,加入(NH4)2Fe(SO4)2·6H2O晶体后,仍能大量共存的是
A.Na+ H+ Cl- NO3- B.K+ Ba2+ NO3- I-
C.Na+ Mg2+ Cl- SO42- D.Na+ S2- Br- ClO-
14.常温下,0.1mol·L-1某一元酸(HA)溶液中c(OH-)/c(H+)=1×10-8,下列叙述正确的是
A.该溶液中由水电离出的c(H+)=1×10-11 mol·L-1
B.由pH=3的HA与pH=11的NaOH溶液等体积混合,溶液中c(Na+)>c(Ac—)>c(OH―)>c(H+)
C.物质的量浓度均为0.1mol·L-1的HA和NaA溶液等体积混合后,若溶液呈酸性,则c(A-)>c(HA)>c(Na+)>c(H+)>c(OH-)
D.0.1mol·L-1HA溶液与0.05mol·L-1NaOH溶液等体积混合后所得溶液中2c(H+)+c(HA)=c(A-)+2c(OH-)
15.化学用语是学习化学的重要工具。下列用来表示物质变化的化学用语中,正确的是
A.钢铁腐蚀时可能发生的正极反应 4OH– – 4e–= 2H2O + O2↑
B.表示中和热的离子方程式 H+ + OH–= H2O; △H=–57.3 kJ/mol
C.向NH4HSO4的稀溶液中逐滴加入Ba(OH)2溶液至刚好沉淀完全的离子方程式:
NH4+ + H+ + SO42- + Ba2+ + 2OH- = NH3·H2O + BaSO4↓+ H2O
D.硫酸铵浓溶液与氢氧化钠浓溶液混合的离子方程式 NH4+ + OH–= NH3↑+ H2O
16.2005年诺贝尔化学奖获得者施罗克等人发现金属钼的卡宾化合物可以作为非常有效
的烯烃复分解催化剂。工业上冶炼钼的化学原理为
①2MoS2 + 7O2 ![]() 2MoO3 + 4SO2; ②MoO3 + 2NH3·H2O = (NH4)2MoO4
+ H2O;
2MoO3 + 4SO2; ②MoO3 + 2NH3·H2O = (NH4)2MoO4
+ H2O;
③(NH4)2MoO4 + 2HCl = H2MoO4↓+ 2NH4Cl; ④H2MoO4 ![]() MoO3 + H2O;
MoO3 + H2O;
⑤ 用还原剂将MoO3还原成金属钼。则下列说法正确的是
A.MoS2煅烧产生的尾气可直接排空
B.MoO3是金属氧化物,也是碱性氧化物
C.H2MoO4是一种强酸
D.利用H2、CO和铝分别还原等量的MoO3,所消耗还原剂的物质的量之比为3:3:2
![]() 17.在一体积不变的密闭容器中发生如下化学反应:2A(g) B(g)+C(g)。当物质A的起始浓度为1.0
mol·L-1、物质B、C的起始浓度为0时,物质A的浓度、转化率以及物质B的浓度随反应时间的变化如下列各图所示:下列有关说法中正确的是
17.在一体积不变的密闭容器中发生如下化学反应:2A(g) B(g)+C(g)。当物质A的起始浓度为1.0
mol·L-1、物质B、C的起始浓度为0时,物质A的浓度、转化率以及物质B的浓度随反应时间的变化如下列各图所示:下列有关说法中正确的是
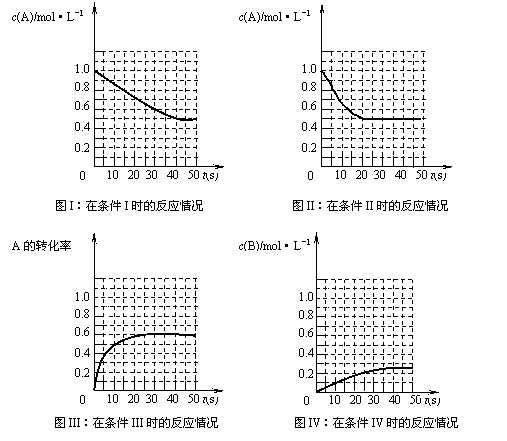
A.条件I、条件II时的反应温度不同,压强相同
B.条件I时可能未使用催化剂,条件II时可能使用了催化剂
C.条件III时的平衡混合物中,物质C的体积分数等于30%
D.条件IV和条件II相比较,条件IV时可能增大了反应体系的压强
18.Wg Na2CO3 ·10H2O晶体溶解在VL水中,在等温下形成饱和溶液密度为ρg/cm3,用c表示物质的量浓度(mol/L),A%为质量分数,S表示溶解度(g),下列表达式正确的是
![]()
![]()
19.氯酸是一种强酸,浓度超过40%时会发生分解,反应可表示为a HClO3 = bO2↑+c Cl2↑+ d HClO4 + e H2O,用湿润的淀粉碘化钾试纸检验气体产物时,试纸先变蓝后褪色。下列说法正确的是
A.由反应可确定:氧化性HClO4>HClO
B.变蓝的淀粉碘化钾试纸褪色是因为可能发生了:5C12 + I2 + 6H2O = 12H+ + 10Cl- + 2IO3-
C.若氯酸分解所得混合气体,lmol混合气体质量为47.6g,则反应方程式可表示为26HClO3 = 15O2↑+ 8C12↑+ 10HClO4 + 8H2O
D.若化学计量数a=8,b=3,则该反应转移电子数为20e—
20.下列有关实验的叙述中,合理的是
①用pH试纸测得氯水的pH为2
②不宜用瓷坩埚灼烧氢氧化钠或碳酸钠固体
③实验室制肥皂时,将适量植物油、乙醇和NaOH溶液混合,并不断搅拌、加热,直到混合物变稠,即可得到肥皂
④用稀硝酸洗涤做“银镜反应”实验后附着在试管壁上的银
⑤在苯酚溶液中滴入少量稀溴水溶液中立即出现白色沉淀。
⑥实验室配制氯化亚锡溶液时,可先将氯化亚锡溶解在盐酸中,再加入蒸馏水稀释,最后加入少量锡粒
⑦所有用到胶头滴管滴加液体的实验,均不可以将胶头滴管伸入试管中,碰到试管壁
A.①②④ B.②③⑥⑦ C.②④⑥ D.②③④⑤⑥
第Ⅱ卷 非选择题(共80分)
三、(本题包括3小题,共 32分)
21.(9分)
⑴(6分)在中学化学实验中可用于分离或提纯的方法很多,如蒸馏、结晶、过滤、盐析……,下列各组混合物的分离或提纯应选用什么方法最合适,若需多步操作,请按顺序填写。
①除去AgI胶体中混有的I—离子 ;
②除去苯中含有的少量苯酚 ;
③分离CuSO4·5H2O和BaSO4的混合物 。
⑵(3分) “磨砂”是增加玻璃仪器密封性的一种处理工艺 ,可使仪器不漏液或不漏气。在下列仪器中: ①试管 ②分液漏斗 ③细口试剂瓶 ④广口试剂瓶 ⑤集气瓶 ⑥滴瓶 ⑦酸式滴定管 ⑧碱式滴定管,肯定用不到“磨砂” 处理的有 (填序号)。
22.(12分)有一包含有碳酸钙的氧化镁粉末,某课外活动小组通过下面的实验来测定混合粉末中氧化镁的质量分数。请你根据他们设计的下列操作步骤进行补充,并回答有关问题。
(1)称取3.3g样品放入锥形瓶中,缓慢滴入60mL3.0mol·L-1的盐酸。滴加盐酸过程中,锥形瓶内可观察到的现象是______。
(2)加入______。
(3)称量一张滤纸(其质量为W1g)安装过滤器,过滤。过滤时,某同学操作不慎,使漏斗里的液体的液面高于滤纸的边缘,该同学发现后,应采取的措施是______。
(4) ______,目的是______。
(5)取滤渣连同滤纸放在坩埚内进行干燥与灼烧至恒重W3g(已知坩埚的质量为W2g),滤渣经灼烧后,固体物的成分(不考虑滤纸灰)是(填化学式)______。
(6)取另一张质量与过滤时所使用的相同的滤纸放在另一坩埚(质量为W4g)内干燥与灼烧至恒重W5g。
则该样品中氧化镁的质量分数为______。
某同学在进行(1)操作称量样品时,是把样品放在托盘天平的右盘里,左盘里共放了3g砝码,天平摆动到达平衡时,游码处于0.3g的刻度上。这位同学的称量操作对最后结果造成的影响是(填无、偏高、偏低)______。
23.(11分)利用如图所示的装置和其他必要的仪器用品,完成下列实验。
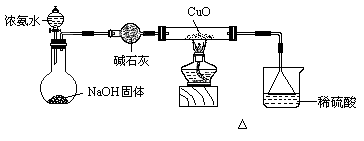 |
(1)证明氨气具有还原性。已知2NH3+3CuO = N2+3Cu+3H2O。
① 碱石灰的作用是________________,稀硫酸的作用是_________________。
②证明NH3具有还原性的实验现象是_________________________________。
(2)用吸收了足量尾气的溶液制取少量硫酸亚铁铵晶体。
已知:硫酸亚铁铵是淡蓝绿色晶体,在空气中性质比较稳定。硫酸亚铁铵在水中的溶解度小于硫酸铵、硫酸亚铁。制备硫酸亚铁铵的化学方程式为:(NH4)2SO4+FeSO4+6H2O= (NH4)2Fe(SO4)2•6H2O。若溶液的pH>8.1,Fe2+将转化为沉淀。
① 吸收了a mol气体后,烧杯中的溶液能使酚酞变红。设计制备硫酸亚铁铵溶液的方案,请简述实验方法。
___________________________________________________________________________________________________________________________________。
② 为了从溶液中分离出硫酸亚铁铵晶体,还需要进行的实验操作是________________
_____________________________________________。
四、(本题包括3小题,共30分)
24. (12分)
A、B、C、D为中学化学中常见的四种气体单质。
(1)已知在空气中A约占21%、C约占78%(均为体积分数);D在标准状况下的密度为3.170g/L。
SO2通入D的水溶液中,可以发生氧化还原反应,其反应的离子方程式为:
(2)在一定条件下B与A、C、D化合分别生成甲、乙、丙。已知甲、乙分子中含有的电子数均与Na+相同;乙与丙可化合生成一种离子化合物。丙的电子式是: 。
在101kPa时,1g乙气体在A单质中充分燃烧,生成一种液态化合物和另一种对环
境无污染的稳定物质,放出18.6kJ的热量。该反应的热化学方程式为
。
(3)乙可以发生如下图所示一系列转化(无关物质及反应条件已略)
|
Z的稀溶液与过量铁粉反应,当反应中有1.806×1024个电子转移时,被还原的Z物质的量是 mol。
(4)将B、C按体积比为3 : 1混合分别装入盛有催化剂的密闭容器I和II中(容积相同),若反应过程中容器I保持温度和压强不变,容器II保持温度和容积不变,当反应达平衡时,容器I内气体的密度 容器II内气体的密度(填“大小”、“小于”或“等于”),理由是 。
在容器I中,当反应达平衡时容积变为起始时的![]() ,则C的转化率为
。
,则C的转化率为
。
25. (10分)氟化钠是一种重要的氟盐,主要用作农业杀菌剂、杀虫剂、木材防腐剂。实验室可通过下图所示的流程以氟硅酸(H2SiF6)等物质为原料制取氟化钠,并得到副产品氯化铵:
![]()
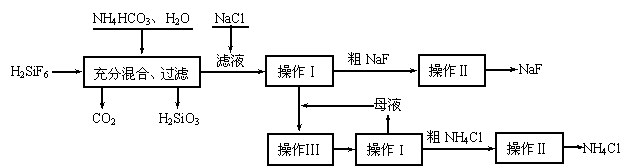
有关物质在水中溶解度分别为:
氯化铵:10℃时33.3 g、20℃时37.2 g、30℃时41.4g;
氟化钠:20℃时4 g;
氟硅酸钠微溶于水。请回答下列问题:
⑴ 上述流程中发生两步化学反应,第一步反应的化学方程式为:
,
第二步反应能进行是因为 。
⑵ 操作Ⅰ需要用到的玻璃仪器除玻璃棒外,还有 。
⑶ 操作II的作用是 。
⑷ 流程中NH4HCO3必须过量,其原因是 。
26.(8分)
学好化学可以使你从感性走向理性,助你学以致用。
⑴已知溶液是一种均一的稳定的混合物。根据均一性可以总结出“溶液中各处的颜色处处相同。”据此,还能得出的结论有:________________________________________;
现有一瓶饱和的石灰水,若要使它变为不饱和溶液,一般可以采用的方法有
。
⑵生产上要配制5000g10%的盐酸来清洗钢材,需38%的盐酸(密度为1.19g/cm3)__________mL(计算结果保留小数点后一位)。
⑶在灾害性事故中,骨折时有发生,通常用石膏来固定骨折部位。石膏可分为熟石膏(CaSO4·![]() H2O,一种白色粉末)和生石膏(CaSO4·2H2O,一种坚硬的固体)两种,医生使用的石膏是 (填名称)。石膏定型时发生的化学反应方程式
。
H2O,一种白色粉末)和生石膏(CaSO4·2H2O,一种坚硬的固体)两种,医生使用的石膏是 (填名称)。石膏定型时发生的化学反应方程式
。
五、(本题包括1小题,共9 分)
27、(9分)
从某些植物树叶提取的挥发油中含有下列主要成分:
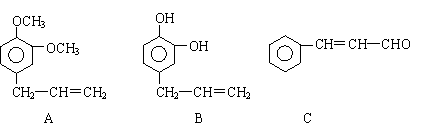
(1)写出A的分子式 。
(2)1molB与溴水充分反应,需消耗 mol单质溴。
(3)写出C在一定条件下与足量H2反应的化学方程式:
。
(4)已知: 写出C在强氧化剂条件下生成的有机化合物的结构简式 。
(5)写出A与B在一定条件下相互反应,生成高分子化合物的化学方程式:
。
六、选做题(本题包括2小题,考生可根据自己的爱好和专长任选一题,两题分值都为10分;如两题都做,取得分较高的一题计入总分)
![]() 28.(10分)已知:R1-CHO+R2-CH2-CHO
28.(10分)已知:R1-CHO+R2-CH2-CHO![]() R1-CH-CH-CHO。有
R1-CH-CH-CHO。有
机物G(C20H18O4)是一种酯,合成路线如下:
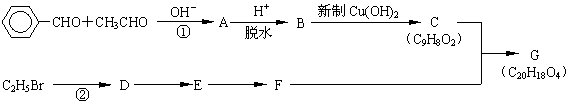
试回答下列问题:
⑴指出反应类型:反应①____________________,反应②_____________________。
⑵A的结构简式是_________________,用系统命名法对E进行命名_____________。
⑶B转化为C的化学方程式是:
_____________________________________________________________________。
⑷有机物C的同分异构体(除C外)中同时含有碳碳双键、苯环和羧基的有:
、 __________________、__________________、__________________。
29.(10分)已知HCN是一种极弱酸,其电离产生的CN-离子能与人体血红蛋白中心离子Fe2+结合,因而有剧毒。通常Fe2+、Fe3+均极易与CN-形成络离子:[Fe(CN)6]3-、[Fe(CN)6]4-,其中[Fe(CN)6]3-在中性条件下能发生水解,生成Fe(OH)3。试回答下列问题:
(1)写出HCN分子的结构式_________________________________。铁原子的电子排布式为_________________________
(2)[Fe(CN)6]3-在中性条件下水解可生成Fe(OH)3,同时还能生成的微粒有_________。
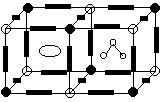 (3)有一种蓝色晶体,其化学式可写作KaFeⅡbFeⅢc(CN)d(H2O)e,其中FeⅡ、FeⅢ分别代表Fe2+、Fe3+离子,晶体的理想结构特征是:(如图)
(3)有一种蓝色晶体,其化学式可写作KaFeⅡbFeⅢc(CN)d(H2O)e,其中FeⅡ、FeⅢ分别代表Fe2+、Fe3+离子,晶体的理想结构特征是:(如图)
①Fe2+和Fe3+分别占据每个立方体互不相邻的顶角上;
②CN-离子以直线形排布在立方体的每条棱边的中间,
(成键方式为Fe2+←C≡N→Fe3+)
③每个立方体的中心均被一个K+或者一个H2O分子占据。
综上所述,试判断:
在该晶体的结构中,每个Fe2+周围结合的C原子围成的空间呈 形;此晶体组成中a∶b∶c∶d∶e =_______________________ 。
参考答案
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | D | B | C | D | C | A | D | D | B | C |
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 | B | BC | C | AD | CD | D | BC | C | BD | C |
三、(本题包括3小题,共 32分)
21.(9分)
⑴渗析 加入NaOH溶液、分液 溶解、过滤、结晶 (每空2分)
⑵①⑧(3分)
22.(12分)
(1)有无色气泡冒出;粉末逐渐溶解,直至全部消失(2分)
(2)加入足量的NaOH稀溶液(2分)
(3)洗涤滤纸和漏斗内壁,沉淀并入原沉淀;然后更换滤纸,重新过滤(2分)
(4)用水洗涤沉淀2~3次;洗去沉淀中可溶性杂质(2分)
(5)MgO(1分)
![]()
23.(11分)
(1) ① 吸收水蒸气(1分) 吸收氨气(1分)
②黑色粉末变为红色,有无色液滴产生(2分)
(2)① 加入稀H2SO4调节溶液至酸性(共2分,加点处和横线处各1分,答“调
pH8.1以下”给分);
加入约0.5a mol 硫酸亚铁的浓溶液,搅拌(共2分,加点处和横线处各1分,答“硫酸亚铁”给分)
② 加热浓缩(1分);冷却结晶(1分);过滤(1分)
四、(本题包括3小题,共30分)
24.(共12分)
|
(2)H : Cl : (1分)
4NH3(g)+3O2(g)=2N2(g)+6H2O(l); △H=-1264.8kJᆞmol-1 (2分)
(3)1mol (2分)
(4)大于; (1分)
该反应是总物质的量减少的反应,总质量不变。若保持温度和体积不变,则混合气体的密度不变;若保持温度和压强不变,则平衡时的混合气体体积变小,密度增大(2分)
25%(2分)
25.(9分)
(1) H2SiF6+6NH4HCO3+H2O=6NH4F+H2SiO3↓+6CO2↑(2分)
NaF比NaCl的溶解性小(2分)
(2) 烧杯、漏斗(1分)
(3) 除去NaF 、NH4Cl 表面的杂质(2分)
(4) 必须保证H2SiF6能全部反应,防止在进行反应Ⅱ时H2SiF6将与NaCl反应,生成Na2SiF6沉淀,混入NaF中影响NaF质量(2分)
(其它合理答案参照给分)
26.(8分)
⑴溶液中化学性质处处相同 溶液中溶质质量分数处处相同(1分)(其他合理答案均给分);加水、 降温、通二氧化碳气体 (2分)
⑵1105.7 (2分)
(3)熟石膏(1分) 2CaSO4·![]() H2O+3H2O===2CaSO4·2H2O(2分)
H2O+3H2O===2CaSO4·2H2O(2分)
27.(9分)
(1)C11H14O2 (2分)
(2)4 (1分)
(3)![]()
![]()
![]()
![]() (2分)
(2分)
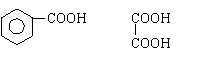
 (4)
(各1分 共2分 )
(4)
(各1分 共2分 )
(5)
(2分)
28.(10分)
⑴加成反应 消去反应 (共2分)
⑵C6H5CH(OH)CH2CHO (2分) 1,2-二溴乙烷(1分)
⑶C6H5CH=CHCHO+2Cu(OH)2![]() C6H5CH=CHCOOH+Cu2O↓+2H2O(2分)
C6H5CH=CHCOOH+Cu2O↓+2H2O(2分)
![]()
![]()
 ⑷
⑷
![]()
29.(每空2分,共10分)
(1)H—C≡N 1s22s22p63s23p6 3d64s2
(2)HCN、CN-
(3)正八面体 1∶1∶1∶6∶1