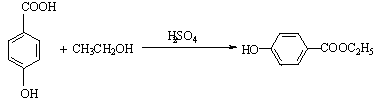
高中毕业班化学质量检查试题Ⅱ
化 学 试 题
本试卷分为第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。满分108分,考试时间60分钟。
相对原子质量:H 1 C 12 N 14 O 16 C1 35.5 Mg 24 A1 27
一、选择题(本题包括13小题。每小题只有一个选项符合题意)
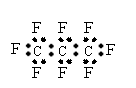 6、最近美国宇航局(NASA)马里诺娃博士找到了一种比二氧化碳有效104倍的“超级温室气体”—全氟丙烷(C3F8),并提出用其“温室化火星”使其成为第二个地球的计划。有关全氟丙烷的说法正确的是( )
6、最近美国宇航局(NASA)马里诺娃博士找到了一种比二氧化碳有效104倍的“超级温室气体”—全氟丙烷(C3F8),并提出用其“温室化火星”使其成为第二个地球的计划。有关全氟丙烷的说法正确的是( )
A.C3F8 的摩尔质量是188
B.全氟丙烷的电子式为:
C.相同压强下,沸点:C3F8>C3Cl8
D.全氟丙烷分子中既有极性键又有非极性键
7、NA为阿伏加德罗常数,下列说法中正确的是( )
A.铁、铜和稀硫酸构成原电池,当转移了NA个电子时,产生的气体体积一定为11.2 L
B.1mol/L Mg(NO3)2溶液中含有NO3-的数目为2NA
C.室温下,28.0g乙烯和丙烯混合气体中含有的碳原子数为2NA
D.关于反应C2H2(g)+5/2O2(g)=2CO2(g)+H2O(l);△H=-1300 kJ·mol-1,在CO2中若有4NA对共用电子对形成时,放出1300 kJ的能量
8、下列溶液中,有关离子一定能大量共存的是( )
A.能使石蕊呈蓝色的溶液中:Na+、I-、Cl-、NO3-
B.能使甲基橙呈黄色的溶液中:K+、SO32-、SO42-、ClO-
C.能使pH试纸变红色的溶液中:Mg2+、Fe3+、NO3-、[Ag(NH3)2]+
D.能跟金属铝反应生成氢气的溶液中:NH4+、Al3+、Cl-、SO42-
9、TCL集团将于2006年全面采用钛金属技术。单质钛的机械强度高,抗蚀能力强,有“未来金属”之称。工业上常用硫酸分解钛铁矿(FeTiO3)的方法来制取TiO2,再由TiO2制金属钛,主要反应有:①FeTiO3+3H2SO4 =Ti(SO4)2+ FeSO4+3H2O
②Ti(SO4)2+3H2O=H2TiO3↓+2H2SO4 ③H2TiO3 =TiO2+ H2O
④TiO2+2C+2Cl2![]() TiCl4+2CO
⑤TiCl4+2Mg
TiCl4+2CO
⑤TiCl4+2Mg![]() 2MgCl2+Ti
2MgCl2+Ti
下列叙述错误的是( )
A.反应①是非氧化还原反应 B.反应②是水解反应
C.反应④中TiO2是氧化剂 D.反应⑤是置换反应
10、下列离子方程式书写正确的是( )
A.在碳酸氢铵溶液中加入等物质的量的氢氧化钡溶液
HCO3-+OH- + Ba2+ = BaCO3↓+H2O
B.4mol·L-1的NaAlO2溶液和7mol·L-1的HCl溶液等体积混合均匀
4AlO2-+ 7H+ + H2O = 3Al(OH)3↓+ Al3+
C.向Fe(OH)3中加入氢碘酸: Fe(OH)3+3H+=Fe3++3H2O
D.电解饱和MgCl2溶液: 2Cl- +2H2O = 2OH-+H2↑+Cl2↑
11、下列实验设计能够成功的是( )
| 实验目的 | 实验步骤及现象 | |
| A | 检验Fe(NO3)2试样是否变质 | 试样加水溶解,加盐酸酸化,加KSCN溶液,出现血红色 |
| B | 检验某卤代烃是否是氯代烃 |
|
| C | 证明酸性条件H2O2氧化性比I2强 |
|
| D | 除去氯化钠晶体中少量硝酸钾 |
|
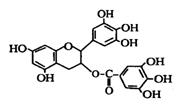 12、美国梅奥诊所的研究人员发现,绿茶中含有EGCG(表没食子儿茶素没食子酸酯)物质具有抗癌作用,能使血癌(白血病)中癌细胞自杀性死亡,已知EGCG的结构如右图所示,有关EGCG的说法中不正确的是( )
12、美国梅奥诊所的研究人员发现,绿茶中含有EGCG(表没食子儿茶素没食子酸酯)物质具有抗癌作用,能使血癌(白血病)中癌细胞自杀性死亡,已知EGCG的结构如右图所示,有关EGCG的说法中不正确的是( )
① EGCG能与碳酸钠溶液反应放出二氧化碳 ② EGCG遇FeCl3溶液能发生显色反应 ③ 1molEGCG最多可与含10mol氢氧化钠溶液完全作用 ④ EGCG在空气中易氧化
A.①② B.①③ C.②④ D.③④
13、常温下,0.1 mol·L-1某一元酸(HA)溶液中![]() =1×10-8,下列叙述正确的是
=1×10-8,下列叙述正确的是
A.该溶液中由水电离出的c(OH -)=1×10-9 mol·L-1
B.浓度均为0.1mol/L的HA和NaA溶液等体积混合后,若溶液呈酸性,则
c(A-)>c(HA)>c(Na+)>c(H+)>c(OH -)
C.0.1 mol·L-1HA溶液与0.05 mol·L-1 NaOH溶液等体积混合后所得溶液中
c(A-) + c(HA) = c(Na+)
D.0.1 mol·L-1HA溶液与0.05 mol·L-1 NaOH溶液等体积混合后所得溶液中
2c(H+)+ c(HA) = c(A-) + 2c(OH - )
2007年明珠学校高中毕业班质量检查Ⅱ 第Ⅱ卷
26、(15分)下图是部分短周期元素的单质熔点的变化图,根据此图,填写下列空格:
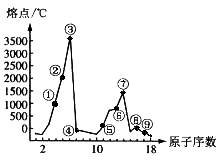 (1)③号元素位于周期表第__________周期_______族,其单质的一种同素异形体能导电,该同素异形体的名称叫______________。
(1)③号元素位于周期表第__________周期_______族,其单质的一种同素异形体能导电,该同素异形体的名称叫______________。
(2)⑤、⑥两种元素形成的最高价氧化物对应的水化物之间相互反应的离子方程式为_____________________________________。
(3)⑦号元素的原子结构简图为_________________。
(4)②、④两元素形成的化合物其晶体有两种结构,其中一种结构与金刚石相似,该结构的晶体属___________晶体,若使其熔化,需破坏的作用力为___________________。
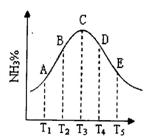 27、(12分)同容器中,分别充入等量的按体积比1:1混合的N2和H2,在不同温度下发生反应N2 + 3H2
27、(12分)同容器中,分别充入等量的按体积比1:1混合的N2和H2,在不同温度下发生反应N2 + 3H2![]() 2NH3,并在第10s时分别测定其中NH3的体积分数并绘成如下图的曲线。
2NH3,并在第10s时分别测定其中NH3的体积分数并绘成如下图的曲线。
(1)A、B、C、D、E五点中,尚未达到化学平衡的点是__________;
(2)该可逆反应的正反应是_______(填“吸热”或“放热”)反应。
(3)由T1 向T2变化时,v正__v逆(填>、<或=,下同);由T3向T4变化时,v正__v逆。
(4)已知E点对应的纵坐标为20%,问E点混合气体的平均相对分子质量是_________,N2的转化率是_________。
28.(16分)Ⅰ在中学实验中学过的可用于分离或提纯物质的方法很多,如重结晶、过滤、盐析……,请将提纯下列各物质(括号内为杂质)最适宜方法的名称填入空格内。
(1)苯(水) 。(2)氢氧化铁胶体(氯离子) 。
(3)碘化钠固体(碘) 。(4)乙醇(食盐) 。
Ⅱ某同学在进行铝和氯化铜溶液反应实验时观察到下列现象:
(1)铝丝表面生成蓬松状的铜;
(2)有气泡逸出,在一段时间内气泡越来越快,点燃发出爆鸣声,证明是氢气。对铝和氯化铜溶液反应产生氢气的原因,该同学作出了很多猜想,并设计了下列实验进行验证:
(一)实验操作
1.取4根洁净的铝纯正作为A组与下列表格中的各物质反应;
2.取4根下半截缠上细铜丝的铝丝作为B组与下列表格中的各物质反应;
3.取4根前面实验中得到的附有蓬松状铜的铝丝作为C组与下列表格中的各物质反应,并与A、B组的反应作对比。
(二)实验现象记录
| 物质 | 热水(t℃) | 2.0mol/L硫酸铜溶液(t℃) | 2.0mol/L氯化铝溶液(t℃) | 饱和氯化钠溶液(t℃) |
| (A) | 开始时有极少量气泡 | 气泡较多,比同浓度氯化铜溶液少 | 有气泡,比热水多 | 气泡比热水多,但比氯化铝溶液少 |
| (B) | 有少量气泡 | 气泡比A多 | 气泡比A多 | 气泡比A多 |
| (C) | 气泡比B多 | 气泡比B多 | 气泡比B多 | 气泡比B多 |
实验现象说明氢气可能是多种因素作用的结果,你认为铝和氯化铜溶液反应中产生氢气的原因可能是哪一些?(不一定填满,不够也可以自己添加)
(1)反应生成的铜和铝组成原电池,促进铝和水反应。
(2) 。
(3) 。
(4) 。
(5) 。
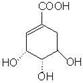
29.(17分)莽草酸是合成抗禽流感药物“达菲”的重要中间体,其分子式为C7H10O5。莽草酸能使溴的四氯化碳溶液褪色,等质量的莽草酸与足量的金属钠或NaHCO3反应时产生的气体体积不等。以下是以莽草酸为原料的一种合成路线(部分反应条件已省略)。
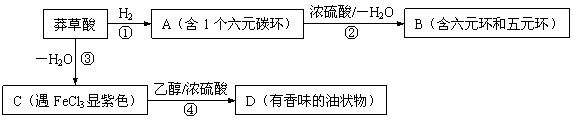
![]()
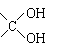 其中A分子中的羧基邻位上没有取代基,C分子中碳环上的氢被取代的一溴代物只有2种。已知有机物分子中含有
或
的结构不能稳定存在。请回答下列问题:
其中A分子中的羧基邻位上没有取代基,C分子中碳环上的氢被取代的一溴代物只有2种。已知有机物分子中含有
或
的结构不能稳定存在。请回答下列问题:
(1)写出莽草酸分子中含有的官能团名称:羧基、 、 。
(2)指出反应类型:① ,③ 。
(3)写出莽草酸的结构简式: 。
(4)写出化学反应方程式:
反应② 。
反应④ 。
高中毕业班质量检查Ⅱ
化学试题参考答案
化学部分(108分)
选择题、6.D 7.C 8.A 9.C 10.B 11.D 12.B 13.D
26、(共15分)(1)二 ⅣA 石墨(各2分)(2)Al(OH)3 + OHˉ= AlO2ˉ + 2H2O(3分)
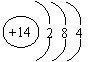 |
(3) (2分)(4)原子 共价键(各2分)
27、(共10分)(1)A、B(2分) (2)放热(2分)
(3)> <(各2分) (4)18(2分)
28.Ⅰ(1)分液(2)渗析(3)升华(4)蒸馏(过滤)
Ⅱ(2)反应放热,促进反应(3)Cu2+水解生成H+(4)Cl-对Al和H2O的反应起催化作用
 (5)蓬松状Cu与Al形成许多原电池
(5)蓬松状Cu与Al形成许多原电池
29.(1)羟基 碳碳双键(2)①加成 ③消去(3)
(4)反应②: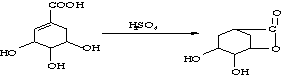
反应④: