高三高考化学冲刺模拟试卷二
第I卷(选择题 64分)
一、选择题(本题包括8小题,共32分,每题只有一个选项符合题意 )
1. 每个公民都应该有安全意识,今年频繁发生的有关化学品泄漏或爆炸事件一次又一次给我们敲响了警钟。下列做法存在安全隐患的是:①将水沿着烧杯内壁缓缓加入浓硫酸中,并用玻璃棒不断搅拌;②给试管中液体加热时,应将试管倾斜,与桌面成45°角,再集中在药品处加热;③取用金属Na或K时,用剩的药品要放回原瓶;④夜间厨房发生煤气泄漏时,应立即开灯检查煤气泄漏原因,并打开所有门窗通风;⑤在做苯酚性质实验时,因为常温时苯酚在水中溶解度较小,所以可以将废液直接通过水池排入下水道;
⑥废旧电池应回收处理。
A.①②④⑤ B.①④ C.①③⑤ D.全部
2.最新科技报导,美国夏威夷联合天文中心的科学家发现了新型氢微粒,这种新粒子是由3个氢原子核(只含质子)和2个电子构成。对于这种微粒,下列说法中正确的是
A.它是氢的一种新的同素异形体 B.它比一个普通H2分子多一个氢原子核
C.它的组成可用H3表示 D.它是氢的一种新的同位素
3.化学用语是学习化学的重要工具。下列用来表示物质变化的化学用语中,错误的是
 |
A.过氧化钠的电子式:![]() B.O2―的结构示意图:
B.O2―的结构示意图:
C.钢铁腐蚀时可能发生的正极反应:2H2O+O2+4e-====4OH—
D.1L0.5mol·L—1的稀硫酸与1L 1mol·L—1的氢氧化钠溶液反应放出57.3kJ的热量:
H2SO4(aq) + 2NaOH(aq) == Na2SO4(aq) + 2H2O(l) ; △H = +57.3kJ·mol-1
4.a、b、c、d是四种短周期元素。a、b、d同周期,c、d同主族。a的原子结构示意图为
![]()
![]() ,b与c形成化合物的电子式为下列比较中正确的是
,b与c形成化合物的电子式为下列比较中正确的是
A.原子半径:a>c>d>b B.原子的氧化性a>b>d>c
C.原子序数:a>d>b>c D.最高价含氧酸的酸性c>d>a
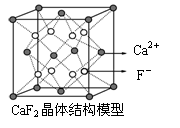 5.下列关于晶体的说法正确的是
5.下列关于晶体的说法正确的是
A.离子晶体中一定不含共价键
B.金属晶体的熔点一定比原子晶体低、一定比分子晶体高
C.CaF2晶体中与一个Ca2+距离最近且距离相等F-的有4个
D.SiO2晶体中每个Si原子与四个O原子以单键相结合
6.下列比较中,错误的是( )
A.体积相同,密度相同的H2与D2中的原子数目:H2>D2
B.等质量的C5H12与C6H12中的电子数:C6H12>C5H12
C.物质沸点的高低:正丁烷>异丁烷
D.晶体熔点的高低:石墨>金刚石
7.锂电池是一种常用的电池,它广泛应用于心脏起搏器,一般可达十年之久,它的反应方程式为Li +MnO2 == LiMnO2,下列有关它的说法错误的是
A.它的负极是锂 B.它的电解质溶液需用非水溶剂配制
C.当有3.01×1023 个电子转移时,正极消耗1mol MnO2
D.它是比容量(单位质量电极材料所能转换的电量)特别大的电池
8.已知t℃ 时,盐M(不含结晶水,相对分子质量:126)的溶解度为S g。在一定量的M的水溶液中加入a g M后,恰好为t℃ 时的饱和溶液。若用M·7H2O代替M,欲使原溶液在t℃时恰好饱和,则需要加入M·7H2O的质量为
A.2a g B.(2+S/100)a g C.200a/(100—S) g D.(1+S/50)a g
二、选择题(本题包括8小题,每小题4分,共32分。每小题有一个或两个选项符合题意。)
9.设NA表示阿伏加德罗常数,下列叙述中正确的是
A.1mol金刚石晶体中含碳碳键数为2 NA
B.常温常压下,22.4L的D2、H2组成的气体分子数约为NA
C.标准状况下,22.4L庚烷中含有的分子数约为3 NA
D.1molNa2O2与足量CO2反应转移的电子数NA
10.下列反应的离子方程式不正确的是
A.溴化亚铁溶液中通入过量氯气.2Fe2+ + 2Br— + 2C12 == 2Fe3+ + Br2 + 4C1—
B.草酸和少量烧碱溶液:H2C2O4 + OH— == HC2O4— + H2O
C.漂白粉溶液吸收过量的二氧化碳:ClO— + H2O + CO2 == HClO + HCO3—
D.向NH4HCO3稀溶液中逐滴加入Ba(OH)2溶液至刚好沉淀完全
NH4+ + H+ + CO32- + Ba2+ + 2OH- = NH3·H2O + BaCO3↓ + H2O
11.将烧碱溶液和盐酸依次滴入某溶液A中,其沉淀(Y轴)和加入溶液的体积(X轴)的关系可能出现两种图示形式,则A溶液不可能是

A.三氯化铝溶液 B.偏铝酸钠溶液 C.明矾溶液 D.硝酸铝溶液
12.周期表中有些元素有“对角线相似”现象(即周期表中处于对角线位置的两元素性质相似),如“Be、Al;B、Si;等两两性质相似。现用熔融LiCl电解的方法可制得金属锂和氯气。若用已潮解的LiC1加热蒸干并强热至熔融,再用惰性电极电解,结果得到金属锂和一种无色无味的气体。据此,下列说法正确的是
A.无色无味的气体为电解生成的锂与水反应放出的H2
B.电解前LiCl在加热时发生了水解
C.电解时产生的无色无味的气体是O2
D.无色无味的气体是阳极放出的Cl2与水作用生成的O2
13.已知甲酸、碳酸、磷酸(H3PO4是一种三元中强酸),其结构式分别为 ![]() 、
、
![]() 、
、 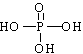 。又知次磷酸(化学式为H3PO2)是一种弱酸,它与过量NaOH溶液反应的产物为NaH2PO2 。则下列判断正确的是
。又知次磷酸(化学式为H3PO2)是一种弱酸,它与过量NaOH溶液反应的产物为NaH2PO2 。则下列判断正确的是
A.NaH2PO2是一种酸式盐 B.NaH2PO2水溶液显酸性
C.H3PO2分子中只含有一个-OH D.H3PO2分子之间可能存在氢键
14.取等质量的单质A和化合物B两种固体,分别投入足量水中,产生C、D两种气体,在一定条件下,C和D可恰好完全反应,则下述正确的是
A.1molA和0.5molB中所含的电子数相等 B.1molA和1molB所含的质子数相等
C.1molA和1molB的质量相等 D.0.5molA和1molB所含的中子数相等
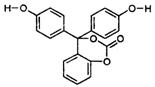 15.如图为某有机物的结构简式,每个节点处代表有一个碳原子,与其结合的氢原子的元素符号省略,这种化学式称为“键线式”。又知酯类在铜铬氧化物(CuO·CuCrO4)催化下,与氢气反应得到醇,羰基双键可同时被还原,但苯环在催化氢化过程中不变,其反应原理如下:
15.如图为某有机物的结构简式,每个节点处代表有一个碳原子,与其结合的氢原子的元素符号省略,这种化学式称为“键线式”。又知酯类在铜铬氧化物(CuO·CuCrO4)催化下,与氢气反应得到醇,羰基双键可同时被还原,但苯环在催化氢化过程中不变,其反应原理如下:
![]()
关于该化合物的下列说法中,正确的是
A.该有机物的化学式为C20H14O5
B.1mol该有机物与溴反应,消耗5molBr2
C.与足量氢氧化钠溶液充分反应,1mol该有机物消耗4molNaOH
D.1mol该有机物在铜铬氧化物催化下能与10mol氢气发生反应
16.反应 ①PCl5(g)
![]() PCl3 (g)+Cl2(g) ②2HI(g)
PCl3 (g)+Cl2(g) ②2HI(g) ![]() H2
(g)+I2(g) ③2NO2(g)
H2
(g)+I2(g) ③2NO2(g) ![]() N2O4(g)
一定条件下,反应从反应物开始,达到化学平衡时,反应物的转化率均相等。若保持各自的温度和体积不变,分别设法取走一定量的各自的反应物,则下列说法正确的是
N2O4(g)
一定条件下,反应从反应物开始,达到化学平衡时,反应物的转化率均相等。若保持各自的温度和体积不变,分别设法取走一定量的各自的反应物,则下列说法正确的是
A.新平衡状态下,反应物转化率:③﹥②﹥①
B.与原平衡相比,新平衡状态下平均摩尔质量①、③减小,②未变
C.反应②中,平衡不移动,I2(g)的浓度不变
D.反应③中,若加入N2O4,与原平衡相比,平衡时NO2的体积分数下降
第Ⅱ卷(非选择题 86分)
三、(本题包括2小题,共22分)
17.(8分)下图为中学常用定量仪器的部分结构(有的仪器被放大),回答下列问题:
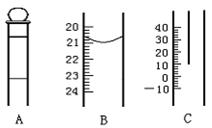
⑴ 中和热测定实验中应用到上述仪器中的 (填序号),该仪器在中和热测定实验中放置的位置是 ;
⑵ 配制一定物质的量浓度溶液的实验中应用到上述仪器中的 (填序号),如果读数时视线偏高,则所得溶液的物质的量浓度将 (填“偏大”“偏小”或“不变”);
⑶ 测定某待测浓度时,一般用 手操作B仪器。
18.(14分)亚铁是血红蛋白的重要组成部分,起着向人体组织传送O2的作用,人如果缺铁就可能出现缺铁性贫血,但是摄入过量的铁也有害。下面是一种补铁药品说明书中的部分内容:该药品为无水碱式盐,含Fe2+34%~36%,是薄衣片,……,与VC(维生素C)同服可增加本品吸收。某同学设计实验对其中的铁成分进行了验证。请一起完成实验:
第一步:查阅资料得知,双氧水可以氧化SCN-生成N2、CO2、和SO42-,也可以将Fe2+ 氧化成 Fe3+。
第二步:向去掉糖衣、研磨好的药品中加稀盐酸,出现淡绿色混浊液,说明有 存在(填离子符号)。
第三步:往上述溶液中滴入几滴KSCN溶液出现浅红色,说明溶液中有少量Fe3+存在。该离子存在的原因可能是(填序号):
① 药品中的铁本来就以Fe3+的形式存在:
② 在制药过程中生成少量Fe3+;
③ 本实验过程中有少量Fe3+生成。
第四步:将第三步所得溶液分成两份,分别装在A、B两个试管中。
第五步:向A试管的溶液中加入少量稀硫酸,再慢慢滴入过量的H2O2溶液,溶液的红色先变深,之后红色逐渐褪去。
红色变深的原因是(用离子方程式表示) 、
红色又逐渐褪去的原因可能是
请自选中学实验室中常用仪器、药品,设计实验证明你的推测
。
第六步:向B试管的溶液中加入一片VC,片刻后溶液红色也褪去,说明VC有 性
怎样理解药品说明书中所述“与VC(维生素C)同服可增加本品吸收”这句话?
。
四、(本题包括2小题,共18分)
19.(8分)A、B、C、D、E都是短周期元素,原子序数依次增大,C的非金属性最强,
B、C同周期,A、D同主族隔周期,E元素原子最外层的电子数是D元素的最外层层电子数的三倍。A、B能形成两种液态化合物甲和乙,原子个数比分别为2∶1和1∶1。根据以上信息回答下列问题:
(1)甲、乙两分子中含有非极性共价键的物质的电子式是________________ ,
C元素在周期表中的位置是__________________。
(2)C和D的离子中,半径较小的是__________(填离子符号)。
(3)将D的单质投入甲中,待D消失后再向上述溶液中加入E的单质,此时发生反应的化学方程式是_____________ ________ _
(4)C、D、E可组成离子化合物,其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如下图所示,阳离子D+(用○表示)位于正方体的棱的中点和正方体内部;阴离子EC6x-(用●表示)位于该正方体的顶点和面心。该化合物的化学式是 。


![]()
![]()
![]()
20.(10分)下图中,B、D、E、F、G是氧化物,F、K是氢化物,C、H是日常生活中
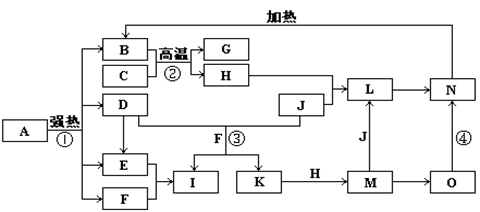
最常见的金属单质,J是气态非金属单质,O是白色沉淀且B、H、L、M、N、O中含有同种元素,I是基础化学工业的重要产品,其消费量是常被视为一个国家工业发达水平的一种标志(图中部分反应物和生成物没有列出)。请按要求回答:
(1)写出L的化学式 ;
(2)写出:反应③的离子方程式 ;
反应④的化学方程式 ;
(3)反应②在工业生产上的用途是 ;
(4)反应①是分解反应,反应中生成的B、D、E、F的物质的量之比为1∶1∶1∶14,则反应①的化学方程式为 。
五、(本题包括1小题,共8分)
21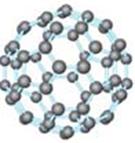 .(8分)20世纪80年代日本科学家应用电子计算机模拟出结构类似于C60(分子结构如右图所示)的物质N60,计算机模拟结果显示,
.(8分)20世纪80年代日本科学家应用电子计算机模拟出结构类似于C60(分子结构如右图所示)的物质N60,计算机模拟结果显示,
N60与C60有相似的结构但稳定性较差。科学家预测,将N2进行冷冻或加压,然后运用高强度激光照射能转变为N60分子团,该分子团具有极强的挥发性,在受热情况下瞬间分解为N2并释放出大量的能量。已知E(N-N)=167kJ·mol-1,E(N=N)=418kJ·mol-1,E(N≡N)=942kJ·mol-1。(E表示键能,即打开1mol气态化学键所需要的能量)回答下列问题:
(1)N60分子中每个N原子最外层有 个电子;
(2)N60稳定性较差的原因可能是 ;
(3)1molN60受热分解为N2时放出的热量为 ;
(4)N60潜在的商业用途可能是 。
六、(本题包括2小题,其20分)
22.(8分)汽车制动液(俗称刹车油)是汽车安全行驶的重要保证,人们称其为“安全卫士”。刹车油既要耐高温、又要抗低温,要达到要求必须用聚乙二醇醚作原料。植物的秸杆、甘蔗渣等富含纤维素,通常农民都在收获季节将它们烧掉,既造成浪费,又严重地污染环境。科学研究发现,它可以代替粮食和乙烯,作为乙醇的重要来源。再将乙醇经过处理,最终可以得到制得刹车油的主要原料——聚乙二醇醚HO(CH2CH2O)n H。
(1)写出纤维素中所含有的决定其主要用途的官能团的名称 。
(2)由葡萄糖转化为乙醇的催化剂为 。
(3)由乙醇制乙二醇的过程中,发生反应的类型为 。
(4)写出由乙二醇制聚乙二醇醚的化学反应方程式 。
23.(12分)M5纤维是美国开发的—种超高性能纤维,在相同的防护级别下,M5纤维比现有的防破片材料轻35%,且防热和防火性能十分出色。据报道,美军士兵佩带的头盔、防弹背心和刚性前后防护板在战争中保住了许多美军士兵的生命。M5纤维是刚杆形又有强力分子间氢键的聚合物,当z是聚合物主链方向时,在x方向与y方向的氢键是其晶体结构的特征。下面是M5纤维的合成路线:(有些反应未注明条件)
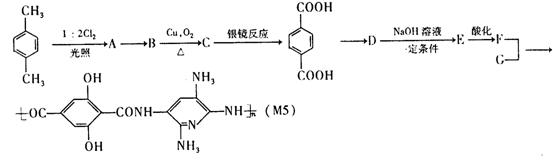
请思考:(1)合成M5的单体的结构简式F ______________,G ______________;
(2)反应类型:A→B______________,B→C______________;
(3)A的同时可能生成的同分异构体______________。
(4)写出化学反应方程式:
C→对苯二甲酸:__________________________________ ;
(5)1mol的F与 NaHCO3溶液反应,最多耗NaHCO3_________ mol;
(6)怎样理解M5纤维分子间有强力氢键?
。
七、(本题包括2小题,共18分)
24.在标准状况下将c molCl2通入含a molFeBr2、b molFeI2的溶液中,当c取不同值时,反应后所得溶液中有不同溶质(不考虑生成物与水的反应)。
(1)下表中空格填满:
| c的取值(用含a、b的代数式表示) | 反应后溶液中溶质的化学式 (只要求写盐类化合物) |
| FeBr2、FeI2、FeCl2 | |
| b≤c<(a +3b)/2 | |
| FeBr3、FeCl3 | |
| FeCl3 |
(2)若a =b =1 、c =2时,反应后溶液中属于盐类的溶质是 (写化学式),这些溶质的物质的量之比是 ;
(3)若a =b =1 、c =2.5时,写出Cl2通入溶液中总的离子方程式(限写一个,但需包括所有的离子反应): 。
25.水垢可以看作由多种物质组成的混合物,为研究含有Ca2+、Mg2+、HCO![]() 的水所形成水垢的化学组成,取干燥的水垢3.16 g,加热使其失去结晶水,得到2.89 g剩余固体A;高温灼烧A至恒重,残余固体为CaO和MgO,放出的气体用过量的Ba(OH)2溶液吸收,得到5.91 g沉淀。
的水所形成水垢的化学组成,取干燥的水垢3.16 g,加热使其失去结晶水,得到2.89 g剩余固体A;高温灼烧A至恒重,残余固体为CaO和MgO,放出的气体用过量的Ba(OH)2溶液吸收,得到5.91 g沉淀。
(1)通过计算确定A中是否含有碳酸镁;
(2)2.89 g剩余固体A灼烧至恒重时产生的气体完全被碱石灰吸收,碱石灰增重1.41 g,通过计算确定A中各成分的物质的量,并计算出水垢中碳酸盐的质量分数。
高三高考冲刺化学模拟二
参考答案及评分标准
17、⑴ C(1分) 悬挂于反应液中(2分)
⑵ A(1分) 偏大(2分) (3) 左(2分)
18、第二步: Fe2+(1分) 第三步:②③(各1分)
第五步:2Fe2+ + H2O2 +2H+ ==2Fe3+ + 2H2O (2分)Fe3+ + 3SCN—==Fe(SCN)3 (2分)
H2O2氧化SCN—,使平衡Fe3+ + 3SCN-==Fe(SCN)3左移,红色消失 (2分)
向A试管,继续加入少量几滴KSCN溶液,溶液又变为红色,说明推测正确(2分)
第六步:还原 (1分)
Fe2+在人体血红蛋白中起传送O2的作用,Fe3+无此功能,服用VC可防止药品中的Fe2+氧化成Fe3+(2分)
19、(10分)(1) ![]() (1分) 第二周期、第ⅦA族(2分) (2) Na+(1分)
(1分) 第二周期、第ⅦA族(2分) (2) Na+(1分)
(3)2Al+2NaOH+2H2O=2NaAlO2+3H2↑(2分) ⑷ Na3AlF6 (2分)
20、(10分,每空2分)
⑴ FeCl3
⑵ SO2+Cl2+2H2O=4H++SO42-+2Cl- 4Fe(OH)2+O2+2H2O=4Fe(OH)3
⑶ 焊接钢轨(或冶炼钒、铬、锰等金属)
⑷ 2FeSO4·7H2O![]() Fe2O3+SO2↑+SO3↑+14H2O
Fe2O3+SO2↑+SO3↑+14H2O
21、(8分,每空2分)
⑴ 8 ⑵ N-N的键能较小
⑶ 13230 kJ ⑷ 用作高能量的炸药或火箭燃料
22、(8分)(1)羟基(2分) (2)酒化酶(2分)
(3)消去反应、加成反应、水解反应(共2分,少一个扣一分,扣完为止)
![]() (4)nHOCH2CH2OH
HO(CH2CH2O)n H+(n—1)H2O(2分)
(4)nHOCH2CH2OH
HO(CH2CH2O)n H+(n—1)H2O(2分)
23、(共12分,其中(1)、(2)小题每空1分,其余各空每空2分)

(2)取代(水解),氧化反应

(5)2mol
(6)—OH、—NH 2等之间均可相互吸引而形成氢键。
24、[(1)、(2)小题每空1分,(3)小题2分,共8分]
(1)
| 0<c<b | |
| FeBr2 FeBr3 FeCl2 FeCl3 | |
| 1/2(a+3b) ≤c<3/2(a+b) | |
| c ≥ 3/2(a+b) |
(2)FeBr3、FeCl3 1:2
(3)4Fe2+ + 4I- + 2Br- +5Cl2 ===4Fe3+ + 2I2 +Br2 + 10Cl-
25、(10分)
(1)根据题意
n(CO2) = n(BaCO3) =5.91 g ÷197 g/mol = 0.03 mol(1分)
若CO2全部来自CaCO3的分解,
则m(CaCO3) = 0.03 mol × 100 g/mol = 3.00 g> 2.89 g(1分)
不合题意,所以, A中一定含有MgCO3(1分)
(2)由题意2.89 g A灼烧时产生的CO2的质量为
m(CO2) = 0.03 mol × 44 g/mol = 1.32 g
故知同时产生的水的质量为 m(H2O) = 1.41 g — 1.32 g = 0.09 g(1分)
即 n[Mg(OH)2] = n(H2O) = 0.09 g÷18 g/mol = 0.005 mol
m[Mg(OH)2] = 0.005 mol×58 g/mol = 0.29 g(1分)
故有
![]() n(CaCO3) + n(MgCO3)
= 0.03 mol
n(CaCO3) + n(MgCO3)
= 0.03 mol
n(CaCO3)×100 g/mol + n(MgCO3)×84 g/mol + 0.29 g = 2.89 g(1分)
解得:n(CaCO3) = 0.005 mol(1分) n(MgCO3) = 0.025 mo(1分)
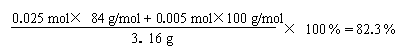 |
(2分)
答:(1)A中含有碳酸镁
(2)水垢中碳酸盐的质量分数为82.3 %