选择题训练(35)
一、选择题(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意。)
1.据环保部门测定,我国一些大城市的酸雨pH=3.5。在酸雨季节铁制品极易腐蚀,则在其腐蚀中正极发生的反应是
A.Fe-2e—=Fe2+ B.2H2O + O2 + 4e—=4OH—
C.2H++2e—= H2↑ D.4OH—-4e—=2H2O+O2↑
2.下列关于只含非金属元素的化合物的说法中,正确的是
A.有可能是离子化合物 B.一定是共价化合物
C.其晶体不可能是原子晶体 D.其晶体不可能是离子晶体
3.糖类、脂肪和蛋白质是维持人体生命活动所必需的三大营养物质。以下叙述正确的是
A.植物油不能使溴的四氯化碳溶液褪色
B.葡萄糖能发生氧化反应和水解反应
C.淀粉水解的最终产物是葡萄糖
D.蛋白质溶液遇硫酸铜后产生的沉淀能重新溶于水
4.下列溶液一定是碱性的是
A.滴加甲基橙后溶液显红色 B.滴加甲基橙后溶液显黄色
C.溶液中含有OH-离子 D.溶液中c (OH—)>c(H+)
5.有机物A和B只由C、H、O中二种或三种元素组成;等物质的量的A和B完全燃烧时,消耗相等物质的量的氧气,则A和B的相对分子质量的差值(其中n为正整数)不可能为
A.0 B.14n C.18n D.44n
6.对某酸性溶液(可能含有Br—、SO42—、H2SO3、NH4+)分别进行如下实验:①加热时放出的气体可以使品红溶液褪色;②加碱调至碱性后,加热时放出的气体可以使润湿的红色石蕊试纸变蓝;③加入氯水时,溶液略显黄色,再加入BaCl2溶液时,产生的白色沉淀不溶于稀硝酸。对于下列物质不能确认其在溶液中是否存在的是
A.Br— B.SO42— C.H2SO3 D.NH4+
7.将50mL0.1 mol·L-1的MgCl2溶液与50mL0.2 mol·L-1的NaHCO3溶液混合后,加热煮沸一段时间(不断地补充蒸发的水),产生的白色沉淀是
A.Mg(HCO3)2 B.MgCO3 C.Mg(OH)2和MgCO3 D.MgCl2和MgCO3
8.已知铅蓄电池放电时发生如下反应:负极:Pb+SO42—=PbSO4+2e—,
正极:PbO2+4H++SO42—+2e—=PbSO4+2H2O。实验室用铅蓄电池作电源,用惰性电极电解CuSO4溶液,当阴极析出2.4g铜时,铅蓄电池内消耗H2SO4物质的量至少是
A.0.050mol B.0.075mol C.0.20mol D.0.40mol
二、选择题(每小题4分,10小题共40分,每小题有一个或两个正确选项。)
9.下列说法中,正确的是
A.周期表中的主族都有非金属元素 B.周期表中的主族都有金属元素
C.周期表中的非金属元素都位于主族 D.周期表中的非金属元素都位于短周期
10.下列事实中,能说明氯的非金属性比硫强的是
A.次氯酸的氧化性比稀硫酸强 B.高氯酸(HClO4)的酸性比硫酸强
C.氯化氢比硫化氢的热稳定性好 D.氯原子最外层电子数比硫原子最外层数多
11.用物质的量都是0.1mol的HCN和NaCN混合后配成1L溶液,已知溶液中的c(CN-)<c(Na+),下列关系式正确的是
A.c(H+)<c(OH—) B.c(HCN)<c(CN—)
C.c(CN—)+c(OH—)=0.1mol·L-1 D.c(HCN)+c(CN—)=0.2mol·L-1
12.将质量分数为a %的NaOH溶液蒸发掉mg水后,变成VmL 2a %的NaOH不饱和溶液,则蒸发后的溶液的物质的量浓度是
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
13.能正确表示下列反应的离子方程式是
A.饱和碳酸氢钙溶液中加入饱和氢氧化钙溶液:Ca2++HCO3—+OH—=CaCO3↓+H2O
B.氯化亚铁溶液中加入硝酸:Fe2+ + 4H+ + NO3— = Fe3+ + 2H2O + NO↑
C.氯气通入冷的氢氧化钠溶液中:2Cl2 + 2OH— = 3Cl—+ ClO—+ H2O
D.氨水中通入过量CO2:2NH3·H2O + CO2 = 2NH4+ + CO32— + H2O
14.在容积一定的密闭容器中,反应2A ![]() B(g) + C(g) 达到平衡后,升高温度容器内气体的密度增大,则下列叙述正确的是
B(g) + C(g) 达到平衡后,升高温度容器内气体的密度增大,则下列叙述正确的是
A.正反应是吸热反应,且A不是气态
B.正反应是放热反应,且A气态
C.其他条件不变,加入少量C,该平衡向逆反应方向移动
D.改变压强对该平衡的移动无影响
15.将一定体积的NaOH溶液分成两等份,一份用pH=2的一元酸HA溶液中和,消耗酸溶液的体积为V1;另一份用pH=2的一元酸HB溶液中和,消耗酸溶液的体积为V2;则下列叙述正确的是
A.若V1>V2,则说明HA的酸性比HB的酸性强
B.若V1>V2,则说明HA的酸性比HB的酸性弱
C.因为两种酸溶液的pH相等,故V1一定等于V2
D.若将两种酸溶液等体积混合,混合酸溶液的pH一定等于2
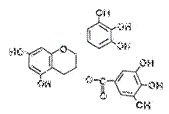 16.美国梅奥诊所的研究人员发现,绿茶中含有EGCG(表没食子儿茶素没食子酸酯)物质具有抗癌作用,能使血癌(白血病)中癌细胞自杀性死亡,已知EGCG的结构式为:
16.美国梅奥诊所的研究人员发现,绿茶中含有EGCG(表没食子儿茶素没食子酸酯)物质具有抗癌作用,能使血癌(白血病)中癌细胞自杀性死亡,已知EGCG的结构式为:
有关EGCG的说法正确的是
A.EGCG能与碳酸钠溶液反应放出二氧化碳
B.EGCG遇FeCl3溶液能发生显色反应
C.1molEGCG最多可与含10mol氢氧化钠的溶液完全作用
D.EGCG在空气中易氧化
17.已知当物质的量浓度相同时,碳酸中c(CO32—)比偏铝酸中c(AlO2—)大得多,则下列推论中正确的是
A.通入适量CO2于AlO2—溶液中,有CO32—生成
B.含CO32—的溶液容易使Al(OH)3溶解变成AlO2—
C.HCO3—只能与Al3+反应而不能和AlO2—反应
D.NaAlO2溶液中加入苯酚溶液后将有沉淀生成
18.已知400℃和1.01×105Pa时的气体摩尔体积为55.20 L/mol,在该条件下有1mol气体X发生如下反应并达到平衡:2X(g)![]() mY(g)+Z(g),测得平衡混合气中X的体积分数为58.80%,混合气体的总质量为46.00 g,混合气体的密度为0.72 g/L。则平衡混合气体的平均相对分子质量为:
mY(g)+Z(g),测得平衡混合气中X的体积分数为58.80%,混合气体的总质量为46.00 g,混合气体的密度为0.72 g/L。则平衡混合气体的平均相对分子质量为:
A.58.80 B.46.00 C.39.74 D.16.13