选择题训练(12)
一、选择题(每小题只有一个正确答案,每小题4分,共32分)
1.下列物质固态时,必定是分子晶体的是 ( )
A.酸性氧化物 B.非金属单质 C.碱性氧化物 D.含氧酸
2.由羟基分别跟下列基团相互结合所构成的化合物中,属于醇类的是 ( C )
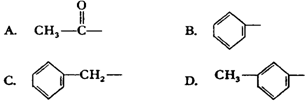
3.钾一钠合金(含50%一80%钾)可用作原子反应堆的导热剂,以下所述该合金的事实跟此项应用无关的是 ( )
A.能跟水剧烈反应 B.具有很高的比热 C.可作冷却剂 D.熔点260.7K
4.下列物质中,可用于治疗胃酸过多的是 ( )
A.硫酸钡 B.氢氧化铝 C.氧化钙 D.碳酸钡
5.为了保护臭氧层,可采取的有效措施是 ( )
A.减少二氧化硫的排放量 B.减少氟氯代烃的排放量
C.减少含铅废气的排放量 D.减少二氧化碳的排放量
6.体积相同的某植物营养液两份,其配方如下:
| KCl | K2SO4 | ZnSO4 | ZnCl2 | |
| (1) | 0.3mol | 0.2mol | 0.1mol | |
| (2) | 0.1mol | 0.3mol | 0.1mol |
两份营养液中各离子浓度 ( )
A.完全相同 B.完全不同 C.仅c(K+)相同 D.仅c(C1—)相同
7.已知两瓶气体分别是HCl 和Cl2 ,可以区别它们的方法或试剂是 ( )
①观察颜色 ②打开瓶盖看有无白雾 ③湿润的淀粉试纸 ④湿润的红色石蕊试纸 ⑤湿润的蓝色石蕊试纸 ⑥AgNO3 溶液
A.①②③④ B.①②⑤⑥ C.①②④⑤ D.①②③⑥
8.浓度为0.5mol/L的盐酸VL,欲使其浓度增大1倍,下列采取的方法正确的是( )
A.加入0.125VL 5mol/L的盐酸 B.通入标准状况下的HCl气体11.2L
C.将溶液加热浓缩至0.5L D.加入10mol/L的盐酸0.1VL,再将溶液稀释至1.5VL
二、选择题(每小题4分,10小题共40分,每小题有一个或两个正确选项。)
9.在2L的密闭容器中把4molA和2molB混合,在一定条件下发生反应3A(g)+2B(g)zc(g)+2D(g)。2min后达到平衡时生成1.6molC,又测得反应速率v(D)=0.2mol/(L·min),下列说法正确的是 ( )
A.B的转化率是20% B.x=4
C.A的平衡浓度是1.4mol/L D.平衡时气体压强是原来的0.94倍
10.若在化学实验中发生下列事故,处理方法正确的是 ( )
A.金属钠着火,用泡沫灭火器扑灭
B.苯酚沾在手上,应马上用NaOH溶液清洗
C.皮肤上沾上浓硫酸,应马上用布拭去,并立即用大量水冲洗
D.酒精灯在桌上歪倒失火后,立即用湿布盖上
11.钡和钠相似,也能形成含O22—的过氧化物,下列叙述中正确的是 ( )
A.过氧化钡的化学式是Ba20: B.O22—的电子式为[:O :O :]2一
C.1mol过氧化钠或过氧化钡跟足量水反应都生成0.5mol氧气
D.过氧化钠或过氧化钡都是强氧化剂
12.下列离子方程式错误的是 ( )
A.向偏铝酸钠溶液中滴加少量盐酸:AlO2—+H++H2O =A1(OH)3↓
B.实验室制取氯气:MnO2 +4H++2C1一Mn2++2H2O +C12 ↑
C.向三氯化铁溶液中加入过量铜屑:2Fe3++Cu=2Fe2++Cu2+
D.用NaOH溶液吸收少量H2S 气体:OH一+H2S =HS一+H2O
13.下列各组溶液混合后一定能产生沉淀的是 ( )
A.硝酸银溶液和氨水 B.氨水和氯化铝溶液
C.硫代硫酸钠溶液和稀硫酸 D.亚硫酸钠溶液和稀硝酸
14.含11.2gKOH的稀溶液与1L0.12mol/L的H2SO4 溶液反应放出11.46kJ的热量。该反应的热化学方程式是 ( )
A.KOH(aq)+1/2H2SO4 (aq)=1/2K2SO4(aq)+H2O (1) △H= 一11.46kJ/mol
B.2KOH(aq)+H2SO4 (aq)=K2SO4(aq)+2H2O (g) △H= 一114.6kJ/mol
C.2KOH(aq)+H2SO4 (aq) =K2SO4(aq)+2H2O (1) △H= 一114.6kJ/mol
D.KOH(aq)+1/2H2SO4 (aq)=1/2K2SO4(aq)+H2O (1) △日= 一57.3kJ/mol
15.氢镍电池是近年开发出来的可充电电池,它可以取代会产生镉污染的镉镍电池。氢
镍电池的总反应式是1/2H2 +NiO(OH) Ni(OH)2。根据此反应式判断,下列叙述中错误的是 ( )
A.电池放电时,电池负极周围溶液的pH不断增大 B.电池放电时,镍元素被氧化
C.电池充电时,氢元素被还原 D.电池放电时,H2 是负极
16.某强酸性溶液中,含有大量的Fe2+、Ba2+、K+,则此溶液中不可能存在的离子是( )
A.MnO4— B.Fe3+ C.NO3— D.Cu2+
17.除去下列各组物质中混有的少量杂质(括号内为杂质)所用试剂不正确的是( )
A.Fe2O3 (A12O3 )用NaOH溶液 B.乙酸乙酯(乙醇)用乙酸
C.铜粉(FeS)用稀H2SO4 D.CO2 (SO2 )用饱和NaHCO3 溶液
18.结构简式是CH2=CHCHO的有机物不能发生的反应是 ( )
A.加成反应 B.银镜反应 C.氧化反应 D.水解反应