08届高考理科综合化学部分二诊试题
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。全卷共300分,考试时间为150分钟。
可能用到的相对原子质量:H—1 C—12 O—16
第Ⅰ卷(选择题,共126分)
本卷共两大题,共21小题,每小题6分。
一、选择题(本题包括13小题。每小题只有一个选项符合题意)
6.德国科学家格哈德 · 埃特尔对有关一氧化碳在金属铂表面的氧化过程的研究,催生了汽车尾气净化装置。净化装置中的催化转化器,可将CO、NO、NO2 和碳氢化合物等转化为无害的物质,有效降低尾气对环境的危害。下列有关说法不正确的是
A.催化转化器中的铂催化剂可加快CO氧化
B.铂表面做成蜂窝状更有利于提高催化效果
C.在铂催化下,NO、NO2 可被CO还原成N2
D.碳氢化合物在铂催化下,被CO直接氧化成CO2和H2O
7.我国成功地发射了嫦娥一号探测卫星,确定对月球土壤中14种元素的分布及含量进行探测等。月球的矿产资源极为丰富,仅月面表层5 cm厚的沙土就含铁单质有上亿吨,月球上的主要矿物有辉石[CaMgSi2O6]、斜长石[KAlSi3O8] 和橄榄石[Mg2SiO4和Fe2SiO4]等。下列说法或分析不正确的是
A.辉石、斜长石及橄榄石均属于硅酸盐矿
B.斜长石的氧化物形式可表示为:K2O·Al2O3·6SiO2
C.橄榄石中铁为+2价
D.月球上有游离态铁是因为月球上铁的活动性比地球上铁的活动性弱
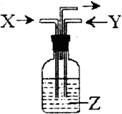 8.下列各组物质中,气体X和气体Y同时通入盛有溶液Z的洗
8.下列各组物质中,气体X和气体Y同时通入盛有溶液Z的洗
气瓶中(如右图所示),一定没有沉淀生成的是
| X | Y | Z | |
| A | Cl2 | SO2 | BaC12 |
| B | NH3 | CO2 | A12(SO4)3 |
| C | NH3 | CO2 | CaC12 |
| D | CO2 | SO2 | CaC12 |
9.短周期元素X、Y、Z、W的原子序数依次增大,X与Z的原子序数之比为3:4,X与W的原子序数相差8,X的次外层电子数与最外层数之比为1:2 。下列叙述正确的是
A.Z分别与X、W形成的化合物的化学键类型和晶体类型都相同
B.Z分别与W、X、Y形成的化合物都能与NaOH溶液反应
C.W与Y形成的化合物属于新型无机非金属材料
D.X、Y、Z、W的原子半径依次减小
10.在一定条件下,可逆反应X(g) + 3Y(g)![]() 2Z(g);△H=-Q kJ/mol(Q>0),若起始浓度分别为c1、c2、c3(均不为0),平衡时X、Y、Z的浓度分别为0.1 mol•L-1、0.3 mol•L-1、0.08 mol•L-1,则下列判断不合理的是
2Z(g);△H=-Q kJ/mol(Q>0),若起始浓度分别为c1、c2、c3(均不为0),平衡时X、Y、Z的浓度分别为0.1 mol•L-1、0.3 mol•L-1、0.08 mol•L-1,则下列判断不合理的是
A.平衡时放出的热量为0.04Q kJ
B.平衡时,Y和Z的生成速率之比为3:2
C.若起始时c3<0.08 mol•L-1,则平衡时X、Y的转化率相等
D.c1的取值范围为0 < c1 < 0.14 mol•L-1
11.下列各组离子能在指定环境中大量共存的是
A.在c(HCO![]() )=0.1 mol/L的溶液中:NH
)=0.1 mol/L的溶液中:NH![]() 、Al3+、Cl-、NO
、Al3+、Cl-、NO![]()
B.在由水电离出的c(H+)=1×10-12 mol/L的溶液中:Fe2+、ClO-、Na+、SO![]()
C.pH=1的溶液中:Mg2+、Fe3+、NO![]() 、[Ag(NH3)2]+
、[Ag(NH3)2]+
D.在使红色石蕊试纸变蓝的溶液中:SO![]() 、CO
、CO![]() 、Na+、K+
、Na+、K+
12.常温下,下列各溶液的叙述中正确的是
A.0.1 mol/L的醋酸钠溶液20 mL与0.1 mol/L盐酸10 mL混合后溶液显酸性,则
c (CH3COO-)>c (Cl-)>c (H+)>c (CH3COOH)
B.pH=7的醋酸钠和醋酸混合液中:c(Na+)=c(CH3COO-) + c(CH3COOH)
C.0.1 mol/L的醋酸的pH=a,0.01 mol/L的醋酸的pH=b,则a + 1>b
D.已知酸性HF>CH3COOH,pH相等的NaF与CH3COOK溶液中,
c(Na+) - c(F-)< c(K+) - c(CH3COO-)
13.三氟化氮(NF3)是一种新型电子材料,它在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有HF、NO和HNO3。则下列说法错误的是
A.反应过程中,被氧化与被还原的元素的物质的量之比为1:2
B.NF3是一种无色、无臭的气体,因此NF3在空气中泄漏时不易被察觉
C.一旦NF3泄漏,可以用NaOH溶液喷淋的方法减少污染
D.若反应中生成1.0 mol NO,转移的电子数目为6.02×1023
第Ⅱ卷(非选择题,共174分)
本卷包括10小题,共174分。
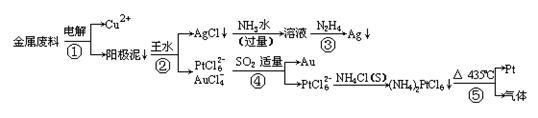
26.(12分)从含银、铜、金和铂的金属废料中提取金、银、铂的一种工艺如下:
|
根据以上工艺回答下列问题:
(1)电解时,以金属废料为阳极,纯铜为阴极,CuSO4溶液为电解液,写出电极反应式:
阳极: ,阴极: 。
若工作一段时间后测得导线上通过了3.01×1024个e-,则阴极有 g铜析出。
(2)步骤④中SO2被氧化成H2SO4,试写出该步骤的离子反应方程式:
;
(3)金和浓硝酸反应的化学方程式为:Au +
6HNO3(浓)![]() Au(NO3)3
+ 3NO2↑+ 3H2O
Au(NO3)3
+ 3NO2↑+ 3H2O
但该反应很难进行,所以金和浓硝酸几乎不反应,但金却可以溶于王水,试简要解释之:
。
27.(16分)已知下图所示各物质的转化关系中,某些反应部分产物已被省去。其中反应②用于常见金属I的冶炼,B为淡黄色固体, D、G、H均为气体且D、H无色。
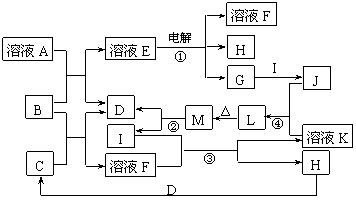
试回答下列问题:
(1)溶液A为 (写名称),B的电子式 。
(2)反应③的离子方程式 ;
反应④的离子方程式 。
(3)有同学认为M也可由溶液J或溶液K各自加热灼烧获得,试判断这种说法是否正确?
(填“是”或“否”),理由是
。
(4)若电解E、J的混合溶液,在电解开始时溶液中有白色沉淀产生,但随着电解的进行,白色沉淀逐渐溶解,最后变为澄清溶液。若要在电解后期得到澄清溶液,E和J的物质的量必须满足的关系是n(E):n(J) 。
28.(16分)相对分子质量为92的某芳香烃X是一种重要的有机化工原料,研究部门以它为初始原料设计出如下转化关系图(部分产物、合成路线、反应条件略去)。其中A是一氯代物,H是一种功能高分子,链节组成为C7H5NO。
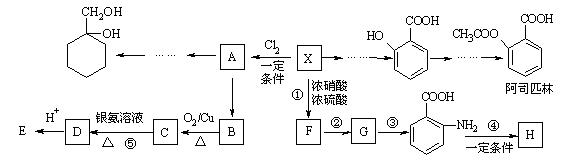
已知:
Ⅰ ![]()
Ⅱ ![]() (苯胺,易被氧化)
(苯胺,易被氧化)
请根据所学知识与本题所给信息回答下列问题:
(1)A的结构简式是 ,H的结构简式是
;
(2)反应②的类型是 ;
(3)反应①的化学方程式是 ;
(4)反应⑤的化学方程式是
____________________________________________;
(5)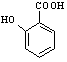 有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物有
有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物有
种;
(6)请用合成反应流程图表示出由![]() 和其他无机物合成
和其他无机物合成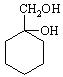 最合理的方案(不超过4步)。
最合理的方案(不超过4步)。
![]() 例:
例:![]()

。
29.(16分)某研究小组用如图所示装置进行铜与浓硫酸反应的实验研究。
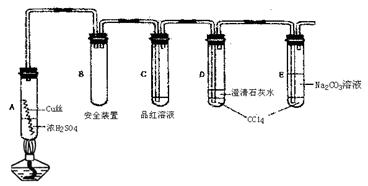 |
试回答下列问题:
(1)A中反应的化学方程式 。
(2)试管C中的实验现象 。
(3)D、E两支试管中CC14的作用是 ,E中反应的离子方程式为 。
(4)对A试管加热,很快C试管中观察到实验现象,但始终未见D试管中澄清石灰水出现浑浊或沉淀。学生猜想是由于SO2溶解度较大,生成了Ca(HSO3)2的缘故。请你设计实验验证该同学的猜想
。
(5)某研究性小组设计的由铜制取CuSO4•5H2O的实验方案如下:
方案1:空气为氧化剂法 将空气或氧气直接通入铜粉与稀硫酸的混合物中几乎不反应。在铜粉和稀硫酸的混合物中加入FeSO4或Fe2(SO4)3,并通入氧气,铜粉逐渐溶解,当铜粉完全溶解后,向其中加入某物质调节pH到3~4,产生红褐色沉淀,过滤,蒸发,结晶,得CuSO4•5H2O。[已知Fe(OH)3和Cu(OH)2完全沉淀时的PH分别为3.7和6.4]
试用离子方程式解释在铜粉和稀硫酸的混合物中加入FeSO4,并通入氧气,铜粉逐渐溶解的原因 。
方案2:将3.2 g铜丝放到45 mL 1.5 mol•L-1的稀硫酸中,控制温度在50℃。加入18 mL 10%的H2O2反应0.5 h后,升温到60℃,待反应1 h后,经过滤,蒸发结晶,减压抽滤等操作后,用少量95%的酒精淋洗并晾干,得CuSO4•5H2O 10.6 g。
该反应的离子方程式为 。
根据有关数据计算出制取CuSO4•5H2O的产率(实际产量与理论产量的百分比)
= 。
评分标准
6.D 7.D 8.D 9.C 10.A 11.D 12.C 13.B
26.(12分)(1)Cu-2e-=Cu2+(2分)、 Cu2+ + 2e-=Cu(2分) 160(2分)
(2)2AuCl4-+3SO2 + 6 H2O =2Au + 8Cl- + 3SO42- + 12H+ (3分)
(3)王水中含有大量的Cl-,Au3+与Cl-可生成AuCl4-,使该平衡中Au3+浓度降低,平衡正移,金即可溶于王水(3分)
27.(16分)(1)盐酸(2分) ![]() (2分)
(2分)
(2)2Al+2H2O+2OH-=2AlO2-+3H2↑(2分) Al3+ + 3AlO2-+ 6H2O == 4Al(OH)3↓(2分)
(3) 否(2分) AlCl3、NaAlO2溶液加热蒸干、灼烧,前者获得Al2O3、后者得到的仍是NaAlO2(3分)
(4)≥1 (3分):
28.(16分)
|
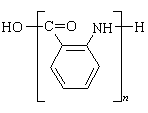 或
或 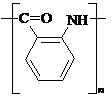 (2分)
(2分)
(2)氧化反应(2分)
(3)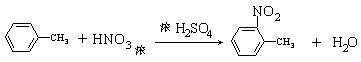 (2分)
(2分)
(4)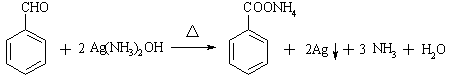 (2分)
(2分)
(5)6 (3分)
(6)
(3分)
29.(16分)
(1)Cu
+ 2H2SO4 (浓)
![]() CuSO4
+ SO2↑+ 2H2O (2分)
CuSO4
+ SO2↑+ 2H2O (2分)
(2)品红溶液褪色 (1分)
(3)防止倒吸(1分) SO2 + H2O + 2CO32- = SO32- + 2HCO3- 或其它合理答案(2分)
(4)取样后,向其中加入氢氧化钠溶液,观察是否有沉淀生成(或加盐酸,加热检验是否有使品红溶液褪色的气体产生) (2分)
(5)4Fe2++O2+4H+===4Fe3++2H2O(2分) 2Fe3++Cu===2Fe2++Cu2+ (2分)
(6) Cu + H2O2+2H+ ===Cu2+ + 2H2O(2分) 84.8% (2分)