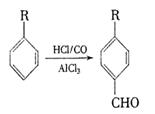
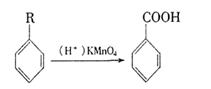
08届高考3月月考理综化学试题
6.中国“嫦娥工程”的首次探月卫星于2007年10月24日成功发射,进行“月球软着陆”, 探月卫星在进入月球大气层时,由于同空气的剧烈摩擦,船体的表面温度将上升到2 000℃―3 000℃,因此卫星表面必须有良好的防高温措施, 下列有关卫星的防高温措施中不可取的是( )
A.使用陶瓷类的贴面覆盖船体,以防止高温侵入舱内
B.使用在一定条件下能熔化或气化的表面覆盖材料
C.使用在一定条件下能与大气层中的氧气发生剧烈燃烧的表面覆盖材料
D.使用在一定条件下能发生分解反应的表面覆盖材料
7.将用于2008年北京奥运会的国家游泳中心(水立方)的建筑采用了膜材料ETFE,该材料为四氟乙烯与乙烯的共聚物,四氟乙烯也可与六氟丙烯共聚成聚全氟乙丙烯。下列说法错误的是( )A.ETFE分子中可能存在“—CH2—CH2—CF2—CF2—”的连接方式
B.合成ETFE及合成聚全氟乙丙烯的反应均为加聚反应
C.聚全氟乙丙烯分子的结构简式可能为![]()
D.四氟乙烯分子中既含有极性键又含有非极性键
8.2008 年北京奥运会主体育场的外形好似“鸟巢” ( The Bird Nest )。有一类硼烷也好似鸟巢,故称为巢式硼烷。巢式硼烷除 B10H14不与水反应外,其余均易与水反应生成氢气和硼酸,硼烷易被氧化。下图是三种巢式硼烷,有关说法正确的是( )
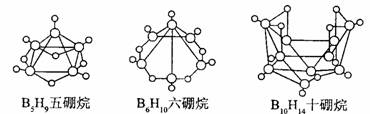
A.这类巢式硼烷的通式是 C nH n + 4
B.2B5H9 + 12O2=5B2O3 十9H2O ,lmolB5H9完全燃烧转移25mol电子
C.8 个硼原子的巢式棚烷化学式应为 B8H10
D.硼烷与水反应是非氧化还原反应
9.现有CuO和Fe2O3组成的混合物a g,向其中加入4.0 mol·L-1硫酸溶液25 mL时恰好完全反应。若将a g原混合物在足量CO中加热,使其充分反应,冷却后剩余固体质量为( )
A.1.6 g B.1.6a g C.(a-0.8) g D.(a-1.6) g
10.在测定液态BrF3电导时发现, 20℃时导电性很强,说明该化合物在液态时发生了电离,存在阴。阳离子。其它众多实验证实,存在一系列有明显离子化合物倾向的盐类,如KBrF4、(BrF2)2SnF6、ClF3·BrF3等。由此推断液态BrF3电离时的阴、阳离子是( )。
A. Br3+和F- B. Br2F-和F- C. BrF2+和BrF4- D.BrF52+和BrF2+
11.取等质量的单质A和化合物B两种固体,分别投入足量的水中,产生C、D两种气体。一定条件下,C和D恰好可完全反应,则下列叙述中正确的是( )
(A)1 molA和1 molB的质量相同 (B)1 molA和1 molB中所含的质子数相同
(C)1molA和1/2molB所含的电子数相同 (D)1/2molA和1molB中所含的中子数相同
12.20世纪90年代,在材料科学中形成一门新型学科--智能材料学。所谓智能材料是指能够感知环境变化,通过自我判断和得出结论,实行自我指令和自我执行的新型材料。如敏感陶瓷、光敏变色玻璃等。这些材料属于下列中的( )
 A.无机非金属材料B. 金属材料C.功能高分子材料D.复合材料
A.无机非金属材料B. 金属材料C.功能高分子材料D.复合材料
13.常温常压下,注射器甲中装有NO2气体,注射器乙中装有相同体积的空气,注射器与U形管连通,如图所示,打开两个止水夹,同时向外拉两注射器的活塞,且拉动的距离相等,将会看到U形管中液面(不考虑此条件下NO2与水的反应) ( )
A.a端上升,b端下降B.a端下降,b端上升C.U形管中液面无变化D.无法判断
26.科学家从化肥厂生产的(NH4)2SO4中检出组成为N4H4 (SO4)2的物质,经测定,该物质易溶于水,在水中以SO![]() 和N4H
和N4H![]() 两种离子存在,植物的根系极易吸收N4H
两种离子存在,植物的根系极易吸收N4H![]() 离子,但它遇到碱时,会生成一种形似白磷的N4分子,N4分子不能被植物吸收。
离子,但它遇到碱时,会生成一种形似白磷的N4分子,N4分子不能被植物吸收。
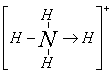 请回答下列问题:
请回答下列问题:
(1) N4和N2的关系正确的是( )
A.同种单质 B.同位素 C.同分异构体 D.同素异形体
(2) N4H4 (SO4)2 (填“能”或“不能”)和草木灰混合施用。
(3)已知白磷、NH4+、N4H![]() 的空间构型均为四面体,NH4+的结构式为
的空间构型均为四面体,NH4+的结构式为
![]()
(→表示共用电子对由N原子单方面提供),白磷(P4 )的结构式,请画出
N4H![]() 的 结构式
的 结构式
![]() (4)已知液氨中存在着平衡.2NH3 NH4++
NH
(4)已知液氨中存在着平衡.2NH3 NH4++
NH![]() 。科学家在液氨中加入氢氧化铯(CsOH)和特殊的吸水剂,使液氨中的NH4+生成N
。科学家在液氨中加入氢氧化铯(CsOH)和特殊的吸水剂,使液氨中的NH4+生成N![]() 分子,请写出液氨与氢氧化铯反应的化学方程式
分子,请写出液氨与氢氧化铯反应的化学方程式
27.在120℃,101kPa条件下,由H2、CH4、CO组成的混合气体a mL,通入一定量(设为x mL)氧气使其完全燃烧。
(1)若a mL混合气体完全燃烧消耗相同条件下氧气的体积也为a mL(即x=a mL),则原混合气体中CH4的体积分数是_____________。(2)(6分)若完全燃烧后生成CO2和H2O(g)的总体积在相同条件下为2a mL,则原混合气体中CH4的体积分数是_____________。现要测定原混合气体中H2的体积分数,还必须知道相同条件下的其它数据可以是 _____________(填选项字母)
A.2a mL混合气体的密度 B.生成CO2气体的总体积 C.生成H2O(g)的总质量
(3)若原混合气体完全燃烧所得气体中只有CO2和H2O(g),则x的取值范围是 _____________。
28.某化学研究小组以铜为电极电解饱和食盐水,探究过程如下:
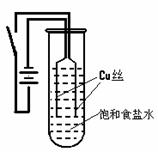
【实验1】:如右下图装置,电源接通后,与电池负极相连的铜丝上有大量气泡产生;与电池正极相连的铜丝由粗变细。电解开始30s内,阳极附近出现白色浑浊,然后开始出现橙黄色浑浊,此时测定溶液的pH约为10。随着沉淀量的逐渐增加,橙黄色沉淀慢慢聚集在试管底部,溶液始终未出现蓝色。
| 序号 | 操作 | 现象 |
| ① | 滴入稀硝酸溶液 | 沉淀溶解,有无色气泡产生,最终得到蓝色溶液。 |
| ② | 滴入稀硫酸溶液 | 橙黄色沉淀转变为紫红色不溶物,溶液呈现蓝色 |
【实验2】:将实验1中试管底部的橙黄色沉淀取出,分装在两支小试管中,以后的操作和现象如下:
阅读资料:常见铜的化合物颜色如下:
| 物质 | 颜色 | 物质 | 颜色 |
| 氯化铜 | 固体呈棕色,浓溶液呈绿色,稀溶液呈蓝色 | 氢氧化亚铜 (不稳定) | 橙黄色 |
| 碱式氯化铜 | 绿色 | 氢氧化铜 | 蓝色 |
| 氧化亚铜 | 砖红色或橙黄色 | 氯化亚铜 | 白色 |
| 溶度积常数/25℃ | 一定温度下,难溶强电解质饱和溶液中离子浓度的系数次方之积为一常数,该常数称为溶度积常,用Ksp表示,Ksp越大则难溶电解质在溶液中溶解趋势越大,反之越小。几种难溶物的Ksp如下: 氯化亚铜:1.2×10-6 氢氧化亚铜:1.4 10-15 氢氧化铜:1.6×10-19 | ||
请回答下列问题:
(1)铜的常见正化合价为___ _、_______,最终试管底部橙黄色沉淀的化学式_______________。
(2)阴极上产生气体所发生的反应为: ;阳极上附近出现白色混浊所发生的反应为: 。
(3)写出实验2中①、②的离子方程式
①___________________________,②____________________________________。
29.已知①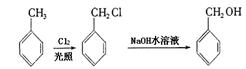
| |||
| |||
② ③
| ||||
| ||||
|
 |
(1)分别写出下列物质的结构简式:F: ,M: 。
(2)写出下列反应的化学方程式:B→C
C+D→H:
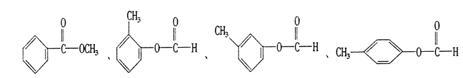
(3)与C互为同分异构体且均属于酯类的芳香族化合物共有6种,除以下四种外,另两种同分异构体的结构简式为: 、 。
|
08年3月月考理综化学
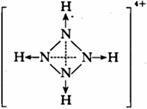 6.C 7.C8.A9.D10.c 11.B12.A 13. B
6.C 7.C8.A9.D10.c 11.B12.A 13. B
26.
(1)D(2分) (2)不能(2分) (3) (3分)
(4)8NH3+4CsOH=N4+4CsNH2+6H2↑十+4H2O(3分)
27. (1)![]() (或33.3%) (4分)
(或33.3%) (4分)
(2)![]() (或50%)(3分) ABC (3分)
(或50%)(3分) ABC (3分)
(3) ![]() a<x<2a (4分)
a<x<2a (4分)
28.(1)+1、+2 ; Cu2O
(2)阴极:2H++2e-=H2↑ 或2H2O+2e-=H2↑+2OH-
阳极:Cu+Cl--e-=CuCl↓;
(3)①3Cu2O + 14H+ + 2NO3-=6Cu2+ + 2NO↑ + 7H2O ;
②Cu2O + 2H+ = Cu + Cu2+ + H2O
29.
|
|
|
CH3 CHO+2Cu(OH)2——→ CH3 COOH+Cu2O↓+2H2O
C+D→H
| |||
| |||
CH3 COOH+ HOCH2 CH3
|
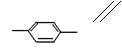 | |||
| |||
![]() CH3
—C—O—CH2 CH3+H2O(3分)
CH3
—C—O—CH2 CH3+H2O(3分)
| |||
| |||
(3) HCOOCH2 、 CH3COO (每空2分,共4分)