高考化学选择题专项训练5
班级 座号 姓名 成绩
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 |
|
|
|
|
|
|
|
|
|
|
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 |
|
|
|
|
|
|
|
|
|
|
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Mg 24 A1 27 K 39 Ca 40 Fe 56
一、选择题(本题包括10小题,每小题3分,共30分。每小题只有一个选项符合题意)
1.遇有下列情况,及时处理有误的是
A.误食重金属盐,立即喝生牛奶或蛋清
B.皮肤不慎沾有苯酚,立即用酒精擦洗
C.金属钠着火,立刻用砂子覆灭
D.晚间进入厨房,闻有很浓的煤气味,立即开灯检查
2.下列各原子或离子的电子排布式错误的是
A.Si 1s22s22p2 B.O2- 1s22s22p6
C.Na+ 1s22s22p6 D.Al 1s22s22p63s23p1
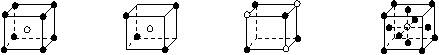 3.有下列离子晶体的空间结构示意图。图中●和化学式中M分别代表阳离子,图中○和化学式中N分别代表阴离子,则化学式为MN2的晶体结构为
3.有下列离子晶体的空间结构示意图。图中●和化学式中M分别代表阳离子,图中○和化学式中N分别代表阴离子,则化学式为MN2的晶体结构为
A B C D
4.氨气分子空间构型是三角锥形,而甲烷是正四面体形,这是因为
A.两种分子的中心原子杂化轨道类型不同,NH3为sp2型杂化,而CH4是sp3型杂化。
B.NH3分子中N原子形成三个杂化轨道,CH4分子中C原子形成4个杂化轨道。
C.NH3分子中有一对未成键的孤对电子,它对成键电子的排斥作用较强。
D.氨气分子是极性分子而甲烷是非极性分子。
5.在密闭容器里,A与B反应生成C,其反应速率分别用![]() 、
、![]() 、
、![]() 表示,已知2
表示,已知2![]() =3
=3![]() 、3
、3![]() =2
=2![]() ,则此反应可表示为
,则此反应可表示为
A、2A+3B=2C B、A+3B=2C C、3A+B=2C D、A+B=C
6.对下列各种溶液中所含离子的判断合理的是
A. 向无色溶液中加氯水变橙色,溶液中可能含: SO42—,Br—,OH—,Ba2+
B.在c(H+)=10-14mol/L的溶液中可能含:Na+,A102—,CO32—,SO32—
C. 某溶液,加铝粉有氢气放出,则溶液中可能含:K+,Na+,H+,NO3-
D.使紫色石蕊试液变红色的溶液中可能含:K+,Na+,Ca2+,HC03—
7.实验室用乙醇和浓硫酸混合加热制得的乙烯气体中含少量SO2(记为混合气体①),碳与浓硫酸共热生成的气体中有CO2和SO2(记为混合气体②)。欲除去这两种混合气体中的SO2,下列说法正确的是:
A、都可通过盛有酸性KMnO4溶液的洗气瓶
B、都可通过盛有NaOH溶液的洗气瓶
C、①可用酸性KMnO4溶液洗气,②可用NaOH溶液洗气
D、①可用NaOH溶液洗气,②可用酸性KMnO4溶液洗气
8.阿伏加德罗常数约为6.02×1023 mol-1,下列叙述正确的是
A.标准状况下,1.12L的SO3所含的原子数约为0.2×6.02×1023
B.在标准状况下,2.24L一氧化氮与氮气混合气所含分子数约为0.1×6.02×1023
C.1molCH3+(碳正离子)中含电子数目约为10×6.02×1023
D.1molD2O含有的中子数约为8×6.02×1023
![]()
![]() 9.某有机物的分子结构如下表示:CH3-CH-C≡C-CH=CH-
-CH3 ,该分子中最多可以有多少个原子共平面:
9.某有机物的分子结构如下表示:CH3-CH-C≡C-CH=CH-
-CH3 ,该分子中最多可以有多少个原子共平面:
A、19 B、20 C、21 D、22
10.近几年一种新型的甜味剂——木糖醇悄悄地走入生活,进入人们的视野,因为木糖醇是一种理想的蔗糖代替品,它具有甜味足,溶解性好,防踽齿,适合糖尿病患者的优点。木糖醇是一种白色粉末状的结晶,分子式为C5H12O5,结构简式为:CH2OH(CHOH)3CH2OH,下列有关木糖醇的叙述中不正确的是:
A、木糖醇是一种五元醇
B、木糖醇是一种无糖型植物甜味剂
C、木糖醇跟葡萄糖、果糖一样,属于单糖
D、木糖醇理论上可以分子内脱水生成环醚
二、选择题(每小题4分,共40分。每小题有一个或两个选项符合题意。)
11、下列离子方程式正确的是
A.硫酸铝溶液中加过量氨水:Al3+ + 4OH- = AlO2- + 2H2O
B.向硅酸钠溶液中通入过量的CO2: SiO32- + 2CO2 + 2H2O = H2SiO3↓+ 2HCO3-
C.过量铁粉与一定量稀硝酸反应:Fe+4H++NO3-=Fe3++NO↑+2H2O
D.向NH4HSO4稀溶液中逐滴加入Ba(OH)2稀溶液至刚好沉淀完全:
Ba2+ + 2OH- + NH4+ +H+ + SO42- = BaSO4↓+ NH3·H2O + H2O
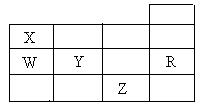 12.右表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是
12.右表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是
A.常压下五种元素的单质中,Z单质的沸点最高
B.Y、Z的阴离子电子层结构都与R原子的相同
C.W的氢化物的沸点比X的氢化物的沸点高
D.Y元素的非金属性比W元素的非金属性强
![]() 13.可以充分说明反应P(g)+Q(g) R(g)+S(g)在恒温下已达到平衡的是
13.可以充分说明反应P(g)+Q(g) R(g)+S(g)在恒温下已达到平衡的是
A.反应容器内的压强不随时间改变
B.反应容器内P、Q、R、S四者共存
C.P的生成速率和S的生成速率相等
D.反应容器内的气体总物质的量不随时间变化
14.已知在1×105Pa、298K条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是
A、H2O(g)=H2(g)+![]() O2(g);
O2(g);![]() H=
+242kJ·mol-1
H=
+242kJ·mol-1
B、2H2(g)+O2(g)+2H2O(l);![]() H= -484kJ·mol-1
H= -484kJ·mol-1
C、H2(g)+![]() O2(g)=H2O(g);
O2(g)=H2O(g);![]() H=
+242kJ·mol-1
H=
+242kJ·mol-1
D、2H2(g)+O2(g)=2H2O(g);![]() H= -484kJ·mol-1
H= -484kJ·mol-1
15.pH值相等的盐酸(甲)和醋酸(乙),分别与锌反应,若最后锌已全部溶解且放出气体一样多,为此下列说法正确的是
A.反应开始时的速率:甲=乙 B.反应所需时间:甲<乙
C.反应开始时,酸的物质的量浓度:甲<乙 D.反应结速时,pH值:甲<乙
16.有五个系列同族元素的物质,101.3kP时测定它们的沸点(℃)如下表所示:
| ① | He -268.8 | (a) -249.5 | Ar -185.8 | Kr 151.7 |
| ② | F2 -187.0 | Cl2 -33.6 | (b) 58.7 | I2 184.0 |
| ③ | (c) 19.4 | HCl -84.0 | HBr -67.0 | HI -35.3 |
| ④ | H2O 100.0 | H2S -60.0 | (d) -42.0 | H2Te -1.8 |
| ⑤ | CH4 -161.0 | SiH4 -112.0 | GeH4 -90.0 | (e) -52.0 |
对应表中内容,下列叙述中正确的是
A.a、 b、c的化学式分别为Ne、Br2、HF
B. 系列②物质均有氧化性;系列③物质对应水溶液均是强酸
C.系列④中各化合物的稳定性顺序为:H20>H2S>H2Se>H2Te
D.上表内物质HF和H2O,由于氢键的影响,其分子特别稳定
17.在一容积可变的密闭容器中,通入1mol X和3 mol Y,在一定条件下发生如下反应
X (g) + 3 Y (g) ![]() 2 Z (g),到达平衡后, Y的转化率为a %, 然后再向容器中通入2 molZ,保持在恒温恒压下反应,当达到新的平衡时,Y的转化率为b
%。 则a与b的关系是
2 Z (g),到达平衡后, Y的转化率为a %, 然后再向容器中通入2 molZ,保持在恒温恒压下反应,当达到新的平衡时,Y的转化率为b
%。 则a与b的关系是
A. a = b B. a > b
C. a < b D. 不能确定
18.白酒、食醋、蔗糖、淀粉等均为家庭厨房中常用的物质,利用这些物质能完成的实验是
A.蛋壳能否溶于酸 B.白酒中是否含甲醇
C.检验自来水中是否含氯离子 D.鉴别食盐和小苏打
19.某温度下,碳酸钠饱和溶液的质量分数为a%,向其中加入x molNa2CO3∙5H2O或ymolNa2CO3,可析出相同质量的Na2CO3∙10H2O,则下列叙述正确的是
A.a%可能为39%,x一定大于y B.a%可能为39%,x可能大于、等于、小于y
C.a%可能为30%,x一定大于y D.a%可能为30%,x可能大于、等于、小于y
20.将2.4 g Fe 、Mg合金投入到一定量的稀硝酸中,金属与硝酸恰好完全反应,共收集到标准状况下的气体V L(硝酸被还原成NO),若向反应后的溶液中加入足量的NaOH溶液,待金属元素全部沉淀后,再将沉淀过滤、洗涤、灼烧后称量,质量为3.6 g。则收集到的气体体积V值可为
A.0.986 B.1.12 C.3.36 D.6.72
参考答案
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| D | A | B | C | A | B | D | B | C | C | BD | D | C | AD | AC | AC | A | AD | C | AB |