08届高考化学复习模拟考试试卷
注意事项:
本试卷分为第I卷(选择题)和第II卷(非选择题)两部分,共120分。考试时间100分钟
第I卷(选择题,共48分)
一、选择题(本题包括8小题,每小题3分,共24分,每小题只有一个选项符合题意)
1、据报道,2006年11月一名俄罗斯前特工在英国因钋中毒而死。已知钋单质为银白色金属,在黑暗中能发光,它有两种不同结构的单质α-Po和β-Po,钋元素的质量数从192到218的全部核素,其常见化合价为+2、+4、+6。下列有关钋元素的说法中错误的是
A.钋元素是由居里夫妇并命名的放射性元素
B.α-Po和β-Po,钋元素的同素异形体
C.21084Po和21884Po互为同位素
D.钋元素的相对原子质量是由钋的各种核素的质量数与其原子个数百分比的乘积求和得到的
2、现有四种晶体,其离子排列方式如图所示,其中化学式不属AB型的是B

3、如下图,分别在两个水槽中盛水和某液体A,再分别滴入一滴苯和水,然后用条型磁铁接近液面,并缓慢移动,水滴跟着移动,而苯滴不移动。则液体A可能为
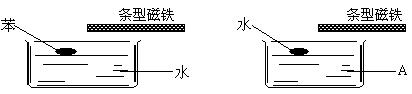
A.煤油 B. 酒精 C. 苯 D. 四氯化碳
4、现在化学教育强调“以人为本”,安全教育是实验的重要内容。下列操作不会发生安全事故的是
A.盛装浓硫酸的铁桶,用水冲洗,并用打火机照明
B.在试管内做钾与水反应的实验
C. 闻氯气的气味时,用手轻轻在瓶口扇动,仅使少量的氯气飘进鼻孔
D. 苯酚沾到皮肤上应立即用清水洗涤
5、下列离子方程式正确的是
A.二氧化硅与氢氧化钠溶液反应:SiO2+2OH— SiO![]() +H2O
+H2O
B.碳酸钙与盐酸反应:CO![]() +2H+
+2H+ CO2↑+H2O
C.硫酸与氢氧化钡溶液反应:Ba2++OH—+H++SO![]()
BaSO4↓+H2O
D.氯气通入冷的氢氧化钠溶液中 2Cl2 + 2OHˉ = 3Clˉ + ClOˉ + H2O
6、在c(H+)∶c(OH-)=1∶2的水溶液中能大量共存的离子组是
A.K+、Al3+、HCO3—、SO42- B.Ca2+、NH4+、CO32-、Cl-
C.Na+、K+、NO3-、ClO- D.Na+、Ba2+、I-、SO32-
7、下列各组物质间反应,其中水既不作氧化剂又不作还原剂的氧化还原反应是
①F2和H2O ②Na和H2O ③Na2O2和H2O
④NO2和H2O ⑤Na2O和H2O ⑥Cl2和H2O
A.③④⑤⑥ B.①⑤ C.②③⑤ D.③④⑥
8、将一定质量的镁和铝混合物投入200 mL硫酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V的变化如右图所示。.则下列说法不正确的是
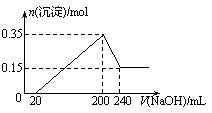 A.镁和铝的总质量为9 g
A.镁和铝的总质量为9 g
B.最初20 mLNaOH溶液用于中和过量的硫酸
C.硫酸的物质的量浓度为2.5 mol·L-1
D.生成的氢气在标准状况下的体积为11.2 L
二、选择题(本题共包括6小题,每小题4分,共24分。每题有1-2个正确答案,少选得2分,不选、错选得0分。)
9、若原子核外电子的排布的基本规律为最外层电子数不超过5个,次外层电子数不超过10个,倒数第三层电子数不超过15个,而各电子层电子的最大容量仍为2n2,则元素周期表中第三、第四、第五周期含有的元素分别有
A.5种、10种、15种
B.8种、18种、18种
C.8种、10种、15种
D.9种、10种、15种
10、据报道,德国INTEGRAL公司研究出无辐射冷却技术(用水和冰组成的物质代替传统的氟利昂或氨)荣获德国环境大奖。关于这种新制冷剂,以下叙述不正确的是
A.该制冷剂对环境不产生任何污染 B.该制冷剂在水的凝固点附近的温度发挥作用
C. 该制冷剂具有与水不同的化学性质 D.该制冷剂的作用原理与液氨基本相同
 11、最近《美国科学院院刊》发表了关于人体体香的研究文章,文章称人的体味中存在两种名为“AND”和“EST”的荷尔蒙。已知同一碳原子上连有四个不同的原子或原子团时,这样的碳原子称为手性碳原子。结合以上信息,下列说法正确的是
11、最近《美国科学院院刊》发表了关于人体体香的研究文章,文章称人的体味中存在两种名为“AND”和“EST”的荷尔蒙。已知同一碳原子上连有四个不同的原子或原子团时,这样的碳原子称为手性碳原子。结合以上信息,下列说法正确的是
A.这两种分子均包含四个手性碳原子 B.与足量氢气加成后的两种物质互为同系物
C.“AND”和“EST”两者分子式之差为CH4 D.“AND”和“EST”化学性质相同
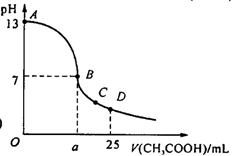 12、在25 mL
0.1 mol/L NaOH溶液中逐滴加入0.2
mol/L CH3COOH溶液,曲线如下图所示,有关粒子浓度关系比较正确的
12、在25 mL
0.1 mol/L NaOH溶液中逐滴加入0.2
mol/L CH3COOH溶液,曲线如下图所示,有关粒子浓度关系比较正确的
A.在A、B间任一点,溶液中一定都有
c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
B.在B点,a>12.5,且有
c(Na+)=c(CH3COO-)=c(OH-)=c(H+)
C.在C点:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
D.在D点:c(CH3COO-)+c(CH3COOH)=2c(Na+)
13、美国科学家成功开发便携式固体氧化物燃料电池,它以丙烷气体为燃料,每填充一次燃料,大约可连续24小时输出50W的电力。一极通入空气,另一极通入丙烷气体,电解质是固态氧化物,在熔融状态下能传导O2-,下列对该燃料电池的说法不正确的是
A.在熔融电解质中,O2-由负极移向正极
B.该电池的总反应是:C3H8+5O2→3CO2+4H2O
C.电路中每流过5 mol电子,标准状况下约有5.6 L丙烷被完全氧化
D.通丙烷的电极为电池负极,发生的电极反应为:C3H8-20e-+10O2-=3CO2+4H2O
14、有一定质量的KNO3样品,在100C下加蒸馏水使之充分溶解,残留固体的质量为250g。该实验在400C下进行时,残留固体质量为120g,700C时为20g。已知KNO3在不同温度下的溶解度:
| 温度 | 100C | 400C | 550C | 700C |
| 溶解度 | 20g | 65g | 100g | 140g |
下列对该样品的推断正确的是
A、样品为纯净物 B、样品中混有不溶于水的杂质
C、样品中混有溶解度较大的杂质 D、当温度在550C左右时KNO3完全溶解
第II卷(非选择题,共72分)
15、(12分)某化学研究性学习小组探讨Fe3+和SO32-之间发生怎样的反应,请你一起参与并协助他们完成实验。
(1)提出猜想:
甲同学认为发生双水解反应:Fe3++ SO32-+6H2O=2Fe(OH)3(胶体)+3H2SO3
乙同学认为发生氧化还原反应,其反应方程式为
(2)实验验证:丙同学设计了下列实验来探究反应的可能性。
①为了检验所用的Na2SO3是否变质,应选用的试剂是
②取5mLFeCl3溶液于试管中,逐滴加入Na2SO3溶液至过量,观察到溶液颜色由黄色变为红棕色(无气泡产生,也无沉淀生成)
③将②溶液分成两等份,其中一份加入稀盐酸至过量,再加入BaCl2稀溶液,有白色沉淀生成;另一份滴入几滴KSCN溶液,溶液变为血红色
(3)得出结论:
①根据丙同学的实验得出的结论是:
②实验③中溶液变成血红色的离子方程式为
(4)拓展探究:
丁同学在FeCl3溶液中加入Na2CO3溶液,观察到红褐色沉淀并且产生无色气体。从形式上看,Na2CO3 和Na2SO3相似,但二者的水溶液与氯化铁溶液反应的现象差别很大,其原因是
(1)Fe3++ SO32-+6H2O= Fe2++ SO42+2H+
(2)BaCl2 和稀盐酸
(3)两个反应同时发生,
Fe(OH)3(胶体)+ SCN-= Fe(SCN)3+3OH-
(4) SO32- 水解能力较CO32-小,且SO32-具有还原性
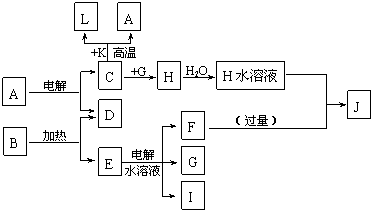 |
16、(12分)A~J分别代表中学化学中常见的一种单质或化合物,其转化关系如图。
已知A在工业上常用作耐火材料,C、D、G、I为短周期元素形成的单质,D、G、I常温下为气态;形成D的元素的原子最外层电子数是次外层的3倍;B在焰色反应中呈紫色(透过蓝色钴玻璃),L是目前应用最广泛的金属。请回答下列问题:
(1)若K为红棕色粉末,写出C与K反应的化学方程式____________________________,引发该反应的操作为_____________________________________________________(2)写出电解E水溶液的化学方程式_____________________。
(3)J与H反应的离子方程式为__________________________。若在上述转化关系中每一步反应均为恰好反应,且不考虑C+K→A+L的变化时,为了最终得到J,则A、B的物质的量之比为______。
(1)2Al+Fe2O3=2Fe+Al2O3
(2)2Cl-+2H2O=2OH-+H2+Cl2
(3)4OH-+Al3+=AlO2-+2H2O 3:4
17、(14分)A、B、C、D、E五种短周期元素,原子序数依次增大,A、E同主族,A元素的原子半径最小,B元素原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物的水化物X与其氢化物反应生成一种盐Y,A、B、C、E四种元素都能与D元素形成原子个数比不相同的常见化合物。回答下列问题:
(1)常温下,X、Y的水溶液的pH均为5。则两种水溶液中由水电离出的H+浓度之比是 。
(2)A、B、D、E四种元素组成的某无机化合物,受热易分解。写出少量该化合物溶液与足量的Ba(OH)2溶液反应的离子方程式 。
(3)将铝片和镁片用导线相连,插入由A、D、E三种元素组成物质的稀溶液中构成原电池,则负极的电极反应式为 。
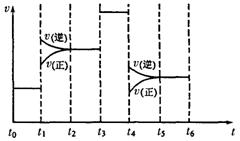 (4)化学反应3A2(g)+C2(g)
(4)化学反应3A2(g)+C2(g)![]() 2CA3(g)。
2CA3(g)。
当反应达到平衡时不断改变条件(不改变A2、C2
和CA3的量),右图表示反应速率与反应过程的关
系,其中表示平衡混合物中CA3的含量最高的一
段时间是 。温度为T℃时,将4a
molA2和2a molC2放人1L密闭容器中,充分反应后测得C2的转化率为50%,则反应的平衡常数
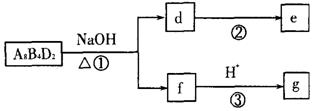 (5)化合物A8B4D2有如下转化关系:
(5)化合物A8B4D2有如下转化关系:
其中,g是常用调味品的主要成分。写出反应①的化学方程式
设计实验方案完成d→e的转化
(1)1:10000 (2)Ba2++OH-+HCO3-=BaCO3+H2O (3)Al-3e=Al3+ (4)t0---t1
2.25/8 (5)CH3COOCH2CH3+NaOH=CH3COONa+CH3CH2OH 用铜作催化剂通人氧气加热
18、(14分)以石油裂解气为原料,通过一系列化学反应可得到重要的化工产品增塑剂G。
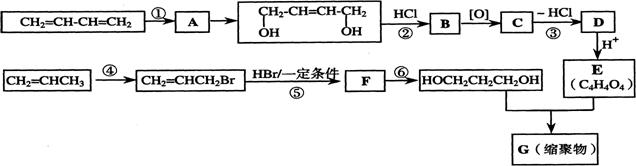
请完成下列各题:
(1)写出反应类型:反应① 反应④
(2)写出反应条件:反应③ 反应⑥
(3)反应②③的目的是: 。
(4)写出反应⑤的化学方程式: 。
(5)B被氧化成C的过程中会有中间产物生成,该中间产物可能是 (写出一种物质的结构简式),检验该物质存在的试剂是 。
(6)写出G的结构简式 。
(1)加成反应 取代反应
(2)NaOH/醇溶液(或KOH醇溶液) NaOH/水溶液
(3)防止双键被氧化
(4)CH2=CHCH2Br+HBr→CH2Br-CH2-CH2Br
(5)HOCH2CHClCH2CHO或OHCCHClCH2CHO或OHCCHClCH2COOH 新制氢氧化铜悬浊液
(6)![]()
19、(11分)下表为长式周期表的一部分,其中的编号代表对应的元素。
| ① | |||||||||||||||||
| ② | ③ | ||||||||||||||||
| ④ | ⑤ | ⑥ | ⑦ | ||||||||||||||
| ⑧ | ⑨ | ⑩ |
请回答下列问题:
(1)表中属于d区的元素是 (填编号)。
(2)表中元素①的6个原子与元素③的6个原子形成的某种环状分子名称为 ;③和⑦形成的常见化合物的晶体类型是________________。
(3)某元素的特征电子排布式为nsnnpn+1,该元素原子的核外最外层电子的孤对电子数为 ;该元素与元素①形成的分子X的空间构形为
(4)某些不同族元素的性质也有一定的相似性,如上表中元素⑤与元素②的氢氧化物有相似的性质。请写出元素②的氢氧化物与NaOH溶液反应的化学方程式: 。
(5) 1183 K以下⑨元素形成的晶体的基本结构单元如图1所示,1183 K以上转变为图2所示结构的基本结构单元,在两种晶体中最邻近的原子间距离相同。

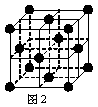
在1183 K以下的晶体中,与⑨原子等距离且最近的⑨原子数为______个,在1183 K以上的晶体中,与⑨原子等距离且最近的⑨原子数为________, 转变温度前后两者的密度比(1183 K以下与1183 K以上之比)___________。(用根号表示)
(1)⑨ (1分) (2)苯 (1分) 分子晶体 (1分)(3) 1 (1分)三角锥形 (1分)(4) Be(OH)2+2NaOH=Na2BeO2+2H2O (1分)(5)8 (1分)12 (1分) ![]() (2分)
(2分)
20、(9分)已知下列几种烷烃的燃烧热如下:
| 烷 烃 | 甲烷 | 乙烷 | 丙烷 | 丁烷 | 戊烷 |
| 燃烧热/(kJ·mol-1) | 890.3 | 1559.8 | 2219.9 | 2877.0 | 3536.2 |
今有10L(在标准状况下)某种天然气,假设仅含甲烷和乙烷两种气体,燃烧时共放出热量480kJ。
⑴试写出乙烷气体燃烧的热化学方程式 ;
⑵计算该天然气中甲烷的体积分数
⑶由上表可总结出的近似规律是____________________
_。
⑴2C2H6(g)+7O2(g)![]() 4CO2(g)+6H2 (g) △H = —3119.6kJ/mol;(2分)
4CO2(g)+6H2 (g) △H = —3119.6kJ/mol;(2分)
⑵72% (4分)
⑶烷烃分子中每增加一个CH2,燃烧热平均增加660kJ/mol 左右(3分)