08届高考化学汕头四中模拟试题(1)
第一部分 选择题共70分
可能用到的相对原子质量:H—1 C—12 N—14 O—16 Na—23
Fe=56
一.选择题(本题包括10小题,每小题3分,共30分,每小题只有一个选项符合题意)
1. 据报道,N5是破坏力极强的炸药之一,18O2是比黄金还贵重的物质。下列说法正确的是
A. 18O2中含18个中子 B. 原子半径:N<18O
C. N5和N2互为同位素 D. 2N5 = 5N2是化学变化
2.下列有关说法不正确的是
A.可以利用电解的方法,从海水中获取淡水资源
B.以海水为原料,制备金属镁的过程中,一定发生了氧化还原反应
C.由铝土矿提取铝的过程中,不涉及置换反应
D.人类探月工程的目的之一是获取月球上的He-3资源
3. 下列除去杂质的实验方法正确的是
A. 除去K2CO3固体中少量NaHCO3:置于坩埚中加热
B. 除去苯中溶有的少量溴苯:置于分液漏斗中分液
C. 除去FeCl3酸性溶液中少量的FeCl2:加入稍过量双氧水后放置
D. 除去蛋白质溶液中混入的少量氯化钠:加AgNO3溶液后过滤
4. 下列关于硅及化合物的叙述正确的是
A. 玛瑙的主要成分是硅酸盐
B. 晶体硅和二氧化硅晶体都常用来制造电子部件
C. 硅和二氧化硅都不与酸反应
D. 硅和二氧化硅都广泛存在于自然界中,天然单质硅叫硅石
5. NA为阿伏加德罗常数,下列说法中正确的是
A. 17gNH4+中含有的电子数为10NA
B. 1mol·L-1 Mg(NO3)2溶液中含有NO3-的数目为2NA
C. 标准状况下,22.4L甲苯所含的分子数为NA
D. 室温下,28.0g乙烯和丙烯中混合气体中含有的碳原子数为2NA
6.下列说法中正确的是
A 石油裂解可以得到氯乙烯
B 油脂水解可得到氨基酸和甘油
C 所有烷烃和蛋白质中都存在碳碳单键
D 淀粉和纤维素的组成都是(C6H10O5)n,水解最终产物都是葡萄糖
7.下列符合化学实验“绿色化”的有:
①在萃取操作的演示实验中,将CCl4萃取溴水改为CCl4萃取碘水
②在铜和浓硝酸反应的实验中,将铜片改为可调节高度的铜丝
③将实验室的废酸液和废碱液中和后再排放
A ①② B ①③ C ②③ D ①②③
8.吸进人体内的O2有2%转化为氧化性极强的活性氧副产物,如 ![]() 等,这些活性氧能加速人体衰老,被称为“夺命杀手”。我国科学家尝试用含硒化合物Na2SeO3消除人体内的活性氧,在消除活性氧时,Na2SeO3的作用是
等,这些活性氧能加速人体衰老,被称为“夺命杀手”。我国科学家尝试用含硒化合物Na2SeO3消除人体内的活性氧,在消除活性氧时,Na2SeO3的作用是
A.氧化剂 B.还原剂
C.既是氧化剂又是还原剂 D.以上均不是
9.下图是化学能与电能相互转换的两套装置。对此两套装置的分析正确的是
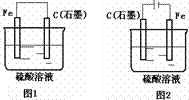
A.两装置中,铁电极上均有气体产生
B.图2装置能将电能转化为化学能
C.石墨电极上发生的电极反应均为:2H++2e-=H2↑
D.随着反应的进行,两装置中电解质溶液的pH均增大
10.下列实验操作完全正确的是
| 编号 | 实验 | 操作 |
| A | 测定pH | 用滴管将溶液滴到表面皿上的pH试纸上 |
| B | 蒸馏 | 使温度计水银球浸在溶液中 |
C | 配制氯化铁溶液 | 将一定量氯化铁溶解在较浓的盐酸中,再用水稀释到所需浓度 |
| D | 蒸发结晶 | 使混合物中的水分完全蒸干后,停止加热 |
二.选择题(本题包括10小题,每小题4分,共40分。每小题有一个或两个选项符合题意。若正确选项只包括一个选项,多选时,该题为0分,若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该小题就为0分)
11. 在密闭容器中,一定条件下进行如下反应:NO(g)+CO(g) ![]()
![]() N2(g)+CO2(g);△H=-373.2kJ·mol-1 ,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是
N2(g)+CO2(g);△H=-373.2kJ·mol-1 ,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是
A. 加催化剂同时升高温度 B. 加催化剂同时增大压强
C. 升高温度同时充入N2 D. 降低温度同时增大压强
12. 下列反应离子方程式正确的是
A.溴化亚铁溶液中通入过量氯气:
Fe2+ + 2Br-—+ 2Cl2= Fe3+ + Br2 + 4Cl—
B.氯气通入冷的氢氧化钠溶液中:
2Cl2 + 2OH— = 3Cl— + ClO—+ H2O
 C.向澄清石灰水中加入少量小苏打溶液:
C.向澄清石灰水中加入少量小苏打溶液:
Ca2+ + OH—+ HCO3— =CaCO3↓+ H2O
D.氨水中通入过量二氧化硫:
2NH3·H2O + SO2 = 2NH4+ + SO32—+ 2H2O
13.下列有关实验问题叙述正确的是
A.测定中和热时,用环形玻璃搅拌棒搅拌溶液使测得的温度更准确
B.利用烧杯、玻璃棒、量筒、容量瓶就可以配制2mol/L的硫酸溶液
C.用pH计测得某次雨水的pH为3.7
D.用标准浓度HCl滴定未知浓度NaOH溶液,中和滴定曲线如上图
14、下列各组离子在溶液中可以大量共存,且加入过量氨水也不产生沉淀的是
A、K+ Ba2+ NO3- SO42- B、H+ NH4+ Al3+ SO42-
C、Na+ AlO2- Cl- OH- D、H+ Cl- CH3COO- NO3-
15、现有下列短周期元素性质的数据:
| 元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径 | 1.02 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 |
| 最高化合价 最低化合价 | +6 | +2 | +1 | +5 | +7 | +1 | +5 | +3 |
| -2 | -3 | -1 | -3 |
下列说法正确的是:
A.⑦号元素的氢化物溶于水显碱性
B.②号的氧化物是离子化合物
C.①号元素的氢化物的水溶液在空气中存放不易变质
D.④号和⑤号元素最高价氧化物对应的水化物都是强酸
16. 常温下将NaOH稀溶液与CH3COOH稀溶液混合,不可能出现的结果是
A. pH>7,且c(OH-)>c(Na+)>c(H+)>c(CH3COO-)
B. pH>7,且c(Na+)+c(H+)=c(OH-)+c(CH3COO-)
C. pH<7,且c(CH3COO-)>c(H+)>c(Na+)>c(OH-)
D. pH=7,且c(CH3COO-)>c(Na+)>c(H+)=c(OH-)
17. 对可逆反应2SO2(g)
+ O2(g) ![]() 2SO3(g),下列判断正确的是
2SO3(g),下列判断正确的是
A. 若单位时间内生成x molSO3的同时,消耗x mol SO2,则反应达到平衡状态
B.
达到化学平衡时,2![]() 正(O2)=
正(O2)=![]() 逆(SO3)
逆(SO3)
C. 平衡时,SO2的浓度必定等于O2浓度的2倍
D. 达到化学平衡时,若增大容器体积,则正反应速率减小,逆反应速率增大
18.下述实验不能达到预期目的的是
| 编号 | 实验内容 | 实验目的 |
A | 将SO2通入溴水中 | 证明SO2具有漂白性 |
| B | 将Cl2通入NaBr溶液中 | 比较氯与溴的氧化性强弱 |
| C | 将铜与浓硝酸反应生成的气体收集后用冰水混合物冷却降温 | 研究温度对化学平衡的影响 |
D | 20℃和50℃分别向两试管中加入同体积同浓度的H2O2溶液,再向其中1支加入少量MnO2 | 研究催化剂对H2O2分解速率的影响 |
19. 单质钛(Ti)的机械强度高,抗蚀能力强,有“未来金属”之称。工业上常用硫酸分解钛铁矿(FeTiO3)的方法来制取TiO2,再由TiO2制金属钛,主要反应有:
① FeTiO3 +2H2SO4=TiOSO4+ FeSO4 +2H2O
② TiOSO4 +2H2O=H2TiO3↓+H2SO4
③ H2TiO3![]() TiO2+H2O
TiO2+H2O
④ TiO2 +2C +2Cl2![]() TiCl4+2CO
TiCl4+2CO
⑤ TiCl4 +2Mg=2MgCl2 +Ti
下列叙述不正确的是
A. 反应①不是氧化还原反应
B. 反应②是水解反应
C. 反应④中TiO2是氧化剂
D. 反应⑤表现了金属镁还原性比金属钛强
20.三氧化二镍(Ni2O3)可用于制造高能电池,其电解法制备过程如下:用NaOH调NiCl2溶液pH至7.5,加放适量硫酸钠后进行电解。电解过程中产生的Cl2在弱碱性条件下生成ClO-,把二价镍氧化为三价镍。以下说法正确的是
A 可用铁作阳极材料
B 电解过程中阳极附近溶液的pH升高
C 阳极反应方程式为:2Cl--2e-=Cl2
D 1mol二价镍全部转化为三价镍时,外电路中通过了1mol电子。
第二部分 非选择题 共80分
三.(本题包括3小题,共30分)
21(8分)某化学兴趣小组按照下列方案进行“由含铁废铝制备硫酸铝晶体”的实验:
步骤1:取一定量含铁废铝,加足量的NaOH溶液,反应完全后过滤。
步骤2:边搅拌边向滤液中滴加稀硫酸至溶液的pH=8~9,静置、过滤、洗涤。
步骤3:将步骤2中得到的固体溶于足量的稀硫酸。
步骤4:将得到的溶液 干燥。
请回答以下问题:
(1)上述实验中的过滤操作需要玻璃棒、_____________等玻璃仪器。
(2)步骤1过滤的目的是_____________________________
(3)步骤2中的溶液pH=8~9时,检验沉淀是否完全的方法是
(4)步骤2中溶液的pH控制较难操作,可改用___________________
(5)将步骤4补充完整
22.(11分)某化学研究性小组要通过实验来证明一种液体(分子式C2H6O)分子的结构。
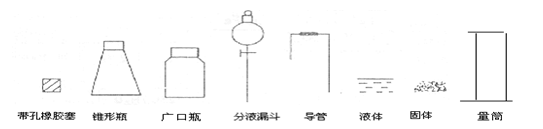 (1)下列简图,画出证明分子结构的实验装置(含试剂)示意图。
(1)下列简图,画出证明分子结构的实验装置(含试剂)示意图。
(2) 实验过程中,使用分液漏斗滴加液体的操作是______________。
(3)实验时测得加入的C2H6O为0.46g,则量筒中最后收集到的水为 mL(假设为标准状况)时,C2H6O的结构简式是C2H5OH。
理由是
(4)若加入的液体是乙醇,测出的H2体积偏小的可能原因是 当乙醇中混有水时,测出的H2体积偏 (填大、小)。
(5)若C2H6O的红外光谱图如下:
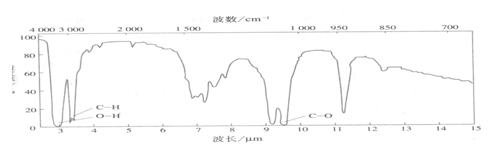
则它的结构简式是
23.(10分)下图是化学研究小组设计的铜与稀硝酸反应的两个实验装置图。其中装置Ⅰ为甲同学设计。
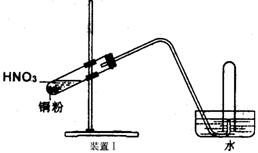
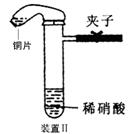

请回答下列问题:
(1)铜与稀硝酸反应的离子方程式为
乙同学认为装置Ⅰ中收集的气体不能确定铜与稀硝酸反应生成的是NO气体,理由是_______________________________________。于是他设计装置Ⅱ。
(2)检验装置Ⅱ的气密性的具体操作和依据是
(3)化学研究小组的其它同学对上述实验进行了研究,认为装置Ⅱ虽然作了改进,但如果按装置Ⅱ进行实验,反应速率较慢,为了解决这个问题,在不加热的条件下,可采取的措施是
(4)按装置Ⅱ进行实验,试管中的气体是淡棕红色,而不是无色。
该采取的措施是:__________________(填具体操作。不能增加装置)。
(5)将装置Ⅱ与Ⅲ连接可避免污染空气,实验结束清洗装置Ⅱ前,应先采取的措施是:__________________
四.(本题包括3小题,共30分)
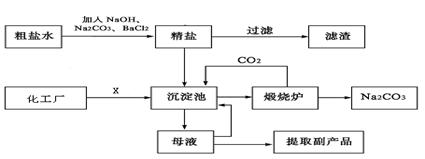
|
(1)为了有效除去粗盐中含有的少量Ca2+、Mg2+、SO42-等杂质,加入试剂的合理顺序为
(2)化工厂提供的X是 ,目的是 生产过程中,需要控制沉淀池温度在30℃~35℃,原因是
(3)煅烧炉发生反应的化学方程式是
(4)该工厂的铁设备易被腐蚀,其正极的电极反应式是
(5)母液可回收利用物质是
25.(10分)一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气催化反应生成甲醇:
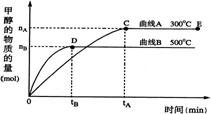 CO(g)+2H2(g)
CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
根据题意完成下列各题:
(1)反应达到平衡时,平衡常数表达式K= ,升高温度,K值 (填“增大”、“减小”或“不变”)。
(2)500℃从反应开始到平衡,氢气的平均反应速率v(H2)=
(3)在其它条件不变的情况下,对处于E点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的是
a 氢气的浓度增大 b 正反应速率加快,逆反应速率也加快
c 甲醇的物质的量增加 d 重新平衡时C(CH3OH) /C(CO)增大
(4)一定条件下,向上述容器中通入3molCO(g)和5molH2(g),此时容器的压强为P(始)。反应进行并达到平衡后,测得容器内气体压强为P(始)的![]() 。若相同条件下,向上述容器中分别通入a molCO(g)、b molH2(g)、c mol CH3OH (g),欲使达到新平衡时容器内气体压强仍为P(始)的
。若相同条件下,向上述容器中分别通入a molCO(g)、b molH2(g)、c mol CH3OH (g),欲使达到新平衡时容器内气体压强仍为P(始)的![]() 。①a、b、c必须满足的关系是
,
。①a、b、c必须满足的关系是
,
(一个用a、c表示,另一个用b、c表示)
②欲使起始时反应表现为向正反应方向进行,则b的取值范围是
26.(10分)“氢能”将是未来最理想的新能源。
(1)实验测得,1克氢气燃烧生成液态水时放出142.9 kJ热量,则氢气燃烧的热化学方程式为 :
A.2H2(g) + O2(g) = 2H2O(l); △H =-142.9 kJ·mol-1
B.H2(g) + 1/2O2(g) = H2O(l); △H =-285.8 kJ·mol-1
C.2H2(g) + O2(g) = 2H2O(l); △H =-571.6kJ·mol-1
D.H2(g) + 1/2O2(g) = H2O(g); △H = -285.8kJ·mol-1
![]()
![]() (2)根据“绿色化学”的思想,为了制备H2,设计了下列反应步骤:
(2)根据“绿色化学”的思想,为了制备H2,设计了下列反应步骤:
![]()
![]() ①CaBr2+H2O CaO+2HBr ②2HBr+Hg HgBr2+H2
①CaBr2+H2O CaO+2HBr ②2HBr+Hg HgBr2+H2
③HgBr2+CaO HgO+CaBr2 ④2HgO 2Hg+O2↑
你认为该方法的主要缺点是
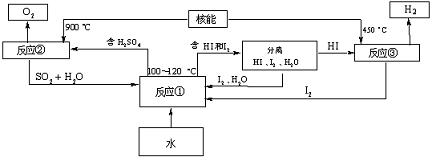
(3)利用核能把水分解制氢气,是目前正在研究的课题。上图是其中的一种流程,其中用了过量的碘,用此法制取氢气最大的优点是:
写出反应①的化学方程式:
(4)有人认为目前利用氢气作为能源不太现实。请问你认为是否现实? (填“不现实”或“现实”),说明能够支持你的观点的两点理由:
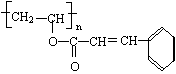 五.(本题包括1小题,共10分)
五.(本题包括1小题,共10分)
27.(10分)感光性高分子又称为“光敏性
高分子”,是一种在彩电荧光屏及大规模集成
电路制造中应用较广的新型高分子材料。其结构简式如上:
(1)在一定条件下,该高聚物可发生的反应有 (填代号)
① 加成反应 ② 氧化反应③ 消去反应④ 酯化反应 ⑤ 卤代反应
(2)该高聚物在催化剂的作用下,水解后的产物中有一种相对分子质量较小的R,其分子式为 。
![]() (3)写出R在一定条件下与乙醇反应的化学方程式:
(3)写出R在一定条件下与乙醇反应的化学方程式:
![]() (4)R的同分异构体有多种,其中含有苯环、 和
(4)R的同分异构体有多种,其中含有苯环、 和
且苯环上有两个对位取代基的结构简式是
六.(本题包括1小题,共10分)
28.(10分)A、B都是芳香族化合物。1 mol A和1 mol某一元羧酸发生酯化反应生成B。B能在一定条件下发生银镜反应而A不能;A、B的相对分子质量都不超过200,完全燃烧都只生成CO2和H2O;A中氧元素的质量分数为31.6%,B的溶液有酸性但不能和FeCl3溶液发生显色反应。
(1)A、B相对分子质量的差值为_____________________________。
(2)一个A的分子中应有________个氧原子,作出此判断的理由是:
A的分子式是:____________。
(3)B的同分异构体甚多。其中不属于酚类且l mol能与4 mol NaOH反应的同分异构体的结构简式为:__________________(任写一种)。
答案
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| D | A | C | B | D | D | D | B | B | C |
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| B | C | AC | C | AB | AD | B | AD | C | CD |
21. (1)烧杯 漏斗 (2分)
(2)除去铁等不溶于碱的杂质(1分)
(3)取上层清液,逐滴加入稀硫酸,若变浑浊,则说明沉淀不完全,基不变浑浊,则说明沉淀完全(2分)
(4)通入足量的CO2气体(2分)
(5) 蒸发浓缩、冷却、结晶、过滤、(2分)
22(1)试剂1分(写C2H5OH得0分)装置2分
(2)打开分液漏斗上口的玻塞,旋开分液漏斗的旋塞缓慢滴加(2分)
(3)112(1分);与足量金属钠反应的C2H6O的物质的量和产生H2的物质的量之比为2:1,说明C2H6O分子中有一个H原子与其它5个H原子不同(2分)
(4)部分乙醇未与钠反应就挥发溶解在广口瓶的水中:大(各1分)
(5)C2H5OH(1分)
23. (1) 3Cu+8H++2NO3―=3Cu2++2NO↑+4H2O(2分)
因为NO2与水反应也可产生NO:3NO2+H2O=2HNO3+NO,故不能肯定生成的NO气体是来自于铜与稀硝酸反应。(2分)
(2)夹紧止水夹,微热试管,若气球鼓起说明气密性良好(2分)
(3)将铜片改为Cu粉(1分)
(4)措施:将铜片和少量的碳酸钠固体放入小气球中,排出气球中的空气并用细绳系好后套在试管上,然后打开夹子,将气球内的碳酸钠固体倒入试管内,最后关上夹子后解开绳子,将铜片倒入试管内。(或先将少量碳酸盐倒入试管,然后迅速系上装有铜片的小气球)(2分)
(5)先使装置Ⅲ中的NaOH溶液倒吸至装置Ⅱ中(1分)
24.(1)BaCl2、Na2CO3、NaOH(2分)
(2)NH3(1分)、提高溶液的pH使CO32—浓度增大(1分)、温度太低速率太慢、温度太高NH4HCO3会分解(1分)
(3)2NaHCO3
![]() Na2CO3 + H2O
+ CO2↑(2分)
Na2CO3 + H2O
+ CO2↑(2分)
(4)2H2O+O2+4e—=4OH—(2分)
(5)NH4Cl(1分)
25.(1)K=c(CH3OH)/c(CO)·c2(H2)
(1分), 减小(1分)
(2)2nB/3tBmol·(L·min)-1(2分)
(3)a、b c
d(全对得2分,少一个扣1分,扣完为止)
(4)a+c=3(1分)、b+2c=5(1分)、2<b≤5(2分)
26.(1)BC (3分,若只选一个对的得1分,全对得3分)
(2)循环过程需要很高的能量,且使用重金属汞会产生污染 (2分)
(3)SO2和I2可循环使用,无污染。 (1分) SO2+I2+2H2O![]() 2HI+H2SO4 (2分)
2HI+H2SO4 (2分)
(4)不现实,理由是现有的制取氢气方法耗能大,制取的成本太高,另外是氢气的熔沸点太低,给储存和运输带来困难。
[或:现实,制取氢气用水为原料,来源丰富;氢气燃烧的产物是水,不会给环境带来任何污染等。(2分)]
27.(1)①、②、⑤ (2分)写对2个给1分,写对3个给2分,写错1个扣1分,但不出现负分,(2)C9H8O2 (2分)
![]() (3)
(3)
(2分)化学式错不给分,漏条件扣1分。
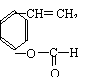 |
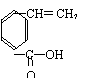 (4)
(4)
(2分) 、 (2分)
28.(1)28(2分)
(2)3(2分)、依题意A分子中至少有一个羧基和一个羟基,而当氧原子数目为4时B的分子量大于200,因此应有3个氧原子(2分)、C8H8O3(2分)
(3)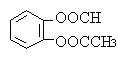 (2分)
(2分)