高考化学文化补习学校第三次月考试题
化 学(问卷) 命题:郑文
注意:
1、本试卷分为问卷和答卷两部分.满分为100分,考试时间为90分钟.
2、请将所有答案填写至答卷上,只交答卷。请注意写清班次、姓名和考号,否则不记分。
可能用到的相对原子质量:H—1 O—16 Al—27 Na—23 Mg—24 N—14 Cu—64
Cl—35.5 Zn—65
第I卷 选择题部分(共44分)
一、选择题(每题只有一个正确答案,每小题2分,共40分)
1.简单原子的原子结构可用右下图表示方法形象表示:其中●表示质子或电子,○表示中子,则下列有关①②③的叙述正确的是( )
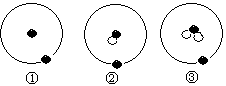 A.①②③互为同位素
A.①②③互为同位素
B.①②③互为同素异形体
C.①②③是三种化学性质不相同的粒子
D.①②③具有相同的质量数
2.最近意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的N4分子。N4分子结构与P4相似,已知断裂1mol N-N吸收167kJ热量,生成1mol N≡N放出942kJ热量。根据以上信息和数据,下列说法正确的是( )
A.N4属于一种新型的化合物 B.N4沸点比P4(白磷)高
C.N4与N2互为同素异形体 D.1mol N4气体转变为N2将吸收882kJ热量
3.下列叙述中正确的是( )
A.CO2分子内含有极性键,所以CO2分子是极性分子
B.分子晶体、原子晶体中一定含有共价键,离子晶体一定含有离子键
C.气态氢化物的稳定性:NH3>PH3>AsH3
D.某非金属元素从游离态变成化合态时,该元素一定被还原
4.向稀硫酸中加入铜粉不发生反应,若再加入下列某种盐,则铜粉可以逐渐溶解。符合此条件的盐是( )
A.NaN03 B.KCl C.ZnS04 D.FeSO4
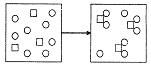 5.物质X(□)和物质Y(〇)的反应如下图所示,对该反应的描述,下列反应方程式正确的是
5.物质X(□)和物质Y(〇)的反应如下图所示,对该反应的描述,下列反应方程式正确的是
A.3X+8Y=X3Y8 B.3X十8Y=3XY2十2Y
C.3X+6Y=X3Y6 D.X+2Y=XY2
6.在一密闭容器中有CO、H2、O2共16.5g,用电火花引燃,使其完全燃烧,再将燃烧
的气体用Na2O2充分吸收,Na2O2增重7.5g,则原混合气体中O2的质量分数是( )A.36% B.54.5% C.40% D.33.3%
7.下列各组中,两种气体的分子数一定相等的是( )
A.质量相等,密度不等的C2H4和N2 B.温度相同,体积相同的O2和N2
C.压强相同,体积相同的O2和N2 D.体积不等,密度相等的CO和C2H4
8.下列叙述正确的是( )
①氯气的性质很活泼,它与氢气混合后立即发生爆炸
②实验室制取氯气时,为了防止环境污染,多余的氯气可以用氢氧化钙溶液吸收
③新制氯水的氧化性强于久置氯水
④检验HCl气体中是否混有Cl2方法是将气体通入硝酸银溶液
⑤除去HCl气体中的Cl2,可将气体通入饱和食盐水
A.①②③ B.②③④ C.③ D.③⑤
9.下列每组物质发生状态变化所克服的粒子间的相互作用属于同类型的是 (C)
A.食盐和蔗糖熔化 B.钠和硫熔化
C.碘和干冰升华 D.二氧化硅和氧化钠熔化
10.设NA为阿佛加德罗常数,下列说法正确的是 ( B )
A.1.8g重水(D2O)中含NA个中子
B.78克Na2O2与过量的CO2充分反应,转移电子数为NA
C.使22.4LHCl气体溶于水,溶液中H+数约为NA
D.1mol羟基与1molNH4+所含电子数均为10NA
11.100g98%的浓硫酸中含氧原子个数约为 ( )
A.6.02×1023 B.4×6.02×1023 C.4.11×6.02×1023 D.4
12.实验室中的药品常按物质的性质、类别不同而有规律地保管着。在做“酸的性质”实验时,实验桌上的部分药品的摆放如图所示。某同学取用KOH溶液以后应把它放回
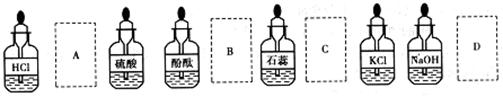 |
13.已知短周期元素的离子aA2+、bB+、cC3—、dD—都具有相同的电子层结构,则下列叙述正确的是( )
A.原子半径A>B>D>C B.原子序数d>c>b>a
C.离子半径C>D>B>A D.单质的还原性B>A>D>C
14.下列反应的离子方程式书写正确的是( )
|
B.电解饱和食盐水 2Cl-+2H2O H2↑+Cl2↑+2OH-
C.碳酸钙与醋酸反应 CaCO3+2H+ Ca2++CO2↑+H2O
D.硫酸亚铁溶液中加入用酸化的过氧化氢溶液 Fe2++2H++H2O2 Fe3++2H2O
15.在酸性溶液中能大量共存,并且溶液为无色透明的离子组是 ( )
A.NH![]() 、Al3+、SO
、Al3+、SO![]() 、NO
、NO![]() B.K+、Na+、CO
B.K+、Na+、CO![]() 、NO
、NO![]()
C.K+、NH![]() 、MnO
、MnO![]() 、SO
、SO![]() D.Na+、K+、NO
D.Na+、K+、NO![]() 、HSO
、HSO![]()
16.下列性质的比较中,正确的是( )
A.熔点:Li>Na>K>Rb B.沸点:NH3<PH3<AsH3<SbH3
C.热稳定性:SiH4>PH3>H2O>HF D.酸性:HClO>H2SO4>H3PO4>H2CO3
17.氯化碘(ICl)跟 水发生反应:ICl+H2O=HIO+HCl,这个过程可以称为ICl的水解。预计PCl3水解的产物是 ( )
A.PH3和HClO B.HCl和H3PO4 C.HCl和H3PO3 D.HCl和HPO3
18.A、B、C、D为四种短周期元素,已知A、C同主族,B、D同周期;A的气态氢化物比C的气态氢化物稳定;B的阳离子比D的阳离子氧化性强;B的阳离子比C的阴离子少一个电子层。下列叙述正确的是( )
A.原子序数:A>B>C>D B.单质熔点:D>B,A>C
C.原子半径:D>B>C>A D.简单离子半径:D>B>C>A
|
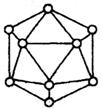
原子。试观察推断这个基本结构单元所含B原子数,
B—B键个数及键角正确的一组是( )
A.20个,60个,360° B.12个,30个,60°
C.9个,18个,45° D.18个,54个,90°
20.郑老师做了一个如图所示的实验,发现烧杯中酸性KMnO4溶液褪色。若将烧杯中的溶液换成有少量KSCN和FeCl2溶液,溶液显红色。判断下列说法中正确的是( )
A.该条件下生成的水分子化学性质比较活泼
B.该条件下H2被冷却为液态氢,液氢的水溶液具有还原性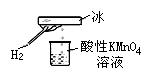
C.该条件下H2燃烧生成了只具有还原性的物质
D.该条件下H2燃烧的产物中可能含有一定量的H2O2
21.Na2Sx在碱性溶液中可被NaClO氧化为Na2SO4,而NaClO被还原为NaCl,若反应中Na2Sx与NaClO的物质的量之比为1:16,则x的值是( )
A.2 B.3 C.4 D.5
22.铜和镁的合金4.7克完全溶于浓硝酸中,若反应中硝酸被还原只产生4480mL的NO2气体和336mL的N2O4气体(都已经折算成标准状况)。在反应后的溶液中加入足量的NaOH溶液,生成沉淀的质量为( )
A.9.02g B.8.26g C.8.61g D.7.04g
第II卷 非选择题部分(共56分)
二、填空题(每空2分,共56分)
23.(12分)下图是元素周期表的一部分,表中所列字母分别代表某一化学元素:
| a | b | c | d | e | ||||||||||||||
| f | g | h | i | |||||||||||||||
| j |
| |||||||||||||||||
(1)g的单质能与f元素的最高价氧化物对应的水化物的溶液反应,请写出该反应的离子方程式 。
(2)将等物质的量的f、g的单质投入足量水中,反应后逐滴加入1mol/L的盐酸溶液,到100mL时能产生最大沉淀。则在该过程中一共放出 L气体(标况)
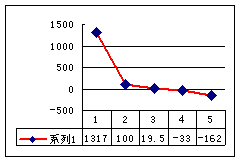
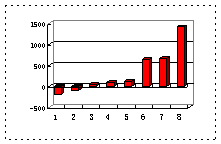
(3)第三周期8种元素按单质熔点(℃)大小顺序的柱形图(上左图),其中序列“2”代表 ,“8”代表 。
(4)a、b、c、d、e的氢化物的沸点直角坐标图(上右图),序列“5”氢化物的化学式为 ,序列“1”的氢化物的电子式: 。
24.(12分)A、B、C、D、E都是短周期元素,原子序数依次增大,B、C同周期,A、D同主族。A、B能形成两种液态化合物甲和乙,原子个数比分别为2∶1和1∶1。C单质的氧化性最强。E的单质既能与强酸反应,也能与强碱反应。根据以上信息回答下列问题:
(1)甲、乙两分子中含有非极性键的物质是________分子(填“极性”或“非极性”)请用电子式表示其形成过程___________________________________________。
(2)C元素在周期表中的位置是__________________。
(3)C和D的离子中,半径较小的是__________(填离子符号)。
(4)将D的单质投入甲中,待D消失后再向上述溶液中加入E的单质,此时发生反应的化学方程式是____________________________________________________。
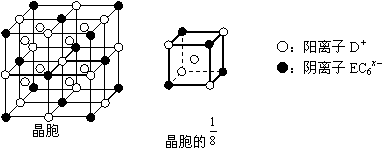 (5)C、D、E可组成离子化合物DxEC6,其晶胞结构如右图所示,阳离子D+位于正方体的棱的中点和正方体内部;阴离子EC6x-位于该正方体的顶点和面心。该化合物的化学式是____________。
(5)C、D、E可组成离子化合物DxEC6,其晶胞结构如右图所示,阳离子D+位于正方体的棱的中点和正方体内部;阴离子EC6x-位于该正方体的顶点和面心。该化合物的化学式是____________。
25.(6分)某无色溶液,由Na+、Ag+、Ba2+、Al3+、、、、中的若干种组成。取该溶液进行如下实验:
(A)取适量试液,加入过量盐酸,有气体生成,并得到溶液;
(B)在(A)所得溶液中再加入过量碳酸氢铵溶液,有气体生成,同时析出白色沉淀甲;
(C)在(B)所得溶液中加入过量Ba(OH)2溶液,也有气体生成,并有白色沉淀乙析出。
根据上述实验回答下列问题:
⑴ 溶液中一定不存在的离子是 。
⑵ 一定存在的离子是 。
⑶ 判断沉淀乙成份的方法是 。
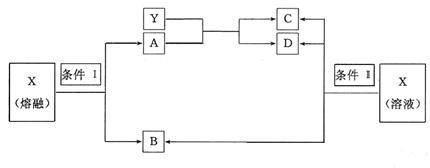
26.(12分)已知A、B、C、D、X、Y六种物质均由短周期元素组成,其中X为常见离子化合物,它们之间的转换关系如下图所示
|
(1)已知条件I和条件II相同,则该反应条件为
(2)物质X的电子式为
(3)写出B与Ca(OH)2反应的化学方程式
(4)写出X在条件II下反应生成B、C、D的离子方程式
(5)写出实验室制B的化学方程式,并标出电子转移方向、数目
(6)请简述鉴定物质X的实验方法: .
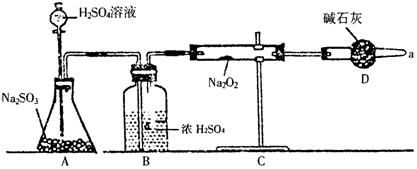
27.(14分)有两个实验小组的同学为探究过氧化钠与二氧化硫的反应,都用如下图所示的装置进行实验。
|
请回答下列问题:
(1)该同学要判断反应中是否有氧气生成,他如何进行实验操作?
装置B的作用是 ;装置D的作用是 。
(2)为确认SO2和Na2O2反应产物,该同学设计了以下实验步骤,你认为应进行的操作顺序排列是(填序号) 。
A.用带火星的木条靠近干燥管口,观察木条是否复燃;
B.将C装置中反应后的固体物质溶于适量水配成溶液;
C.在配成的溶液中加入用硝酸酸化的硝酸钡溶液,观察是否有沉淀生成。
D.在配成的溶液中先加入盐酸,再加入氯化钡溶液,观察是否有气泡或沉淀生成。
(3)第1小组同学认为Na2O2与SO2反应生成了Na2SO3和O2,该反应的化学方程式是: 。
(4)第2小组同学认为Na2O2与SO2反应生成了Na2SO3和O2外,还有Na2SO4生成。为检验是否有Na2SO4生成,他们设计了如下方案:

上述方案是否合理 。请简要说明理由:
。
![]() 化 学(答卷)
化 学(答卷)
第I卷 选择题部分(每小题2分,共44分)
| 题 号 | 01 | 02 | 03 | 04 | 05 | 06 | 07 | 08 | 09 | 10 | 11 |
| 答 案 | |||||||||||
|
| 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 |
| 答 案 |
第II卷 非选择题部分(每空2分,共56分)
23.(12分)
(1)该反应的离子方程式 。
(2)在该过程中一共放出 L气体(标况)
(3)其中序列“2”代表 ,“8”代表 。
(4)序列“5”氢化物的化学式为 ,
序列“1”的氢化物的电子式: 。
24.(12分)
(1)含有非极性键的物质是________分子(填“极性”或“非极性”)
请用电子式表示其形成过程___________________________________________。
(2)C元素在周期表中的位置是__________________。
(3)C和D的离子中,半径较小的是__________(填离子符号)。
![]() (4)反应的化学方程式是______________________________________________。
(4)反应的化学方程式是______________________________________________。
(5)该化合物的化学式是____________。
25.(6分)
⑴ 溶液中一定不存在的离子是 。
⑵ 一定存在的离子是 。
⑶ 判断沉淀乙成份的方法是 。
26.(12分)
(1)则该反应条件为 ; (2)物质X的电子式为 ;
(3)化学方程式 ;
(4)离子方程式 ;
(5)写出实验室制B的化学方程式,并标出电子转移方向、数目
(6)请简述鉴定物质X的实验方法: .
27.(14分)
(1)实验操作: ;
装置B的作用是 ;装置D的作用是 。
(2)你认为应进行的操作顺序排列是(填序号) 。
(3)该反应的化学方程式是: 。
(4)上述方案是否合理 。
请简要说明理由:
。
参考答案:
19.(13分)(1)合理(2分);SO2具有还原性,Na2O2具有氧化性,二者发生反应
Na2O2+SO2=Na2SO4(2分)
(2)除去水蒸气,干燥SO2(2分);吸收未反应完的SO2,避免污染空气,且防止空气中CO2和水蒸气进入(2分)
(3)①用带火星的木条靠近干燥管口a(1分)
②若木条复燃,则说明有O2生成 (1分)
③取Na2O2反应后的固体混合物适量溶于水配成溶液,先加足量盐酸再加入BaCl2溶液(2分)
④若有白色沉淀生成,证明Na2SO4生成(1分)
25.(1)2Na2O2+2SO2 2Na2SO3+O2
(2)取少量白色固体,加入稀盐酸(或稀硫酸),若产生能使品红褪色的气体,则生成的白色固体中含有Na2SO3
(3)不合理:稀硝酸能将亚硫酸钡氧化为硫酸钡;如果反应后的固体中还残留Na2O2,溶于水后能将亚硫酸根氧化成硫酸根。
四、(共21分)
20.(3分)b
21.(8分)(1)H2SO4>H3PO4>H3AsO4(2分)
![]() (2)NH3>PH3>SiH4(2分)
(2)NH3>PH3>SiH4(2分)
![]()
![]() (3)极性、极性(2分)H×+·S·+×H→H . S H (2分)
(3)极性、极性(2分)H×+·S·+×H→H . S H (2分)
18、(1) 二 IVA (2)氯原子结构示意图
(3)过氧化钠的电子式 (4)H2O、H3O+、OH-
(5)c(S2-)>c(OH-)>c(HS-)
(6)H2(g)+1/2O2= H2O (l);△H=-286kJ/mol
19、(1)H-O-O-H 第二周期、第ⅦA族
(2)Na+
(3)2Al+2NaOH+2H2O=2NaAlO2+3H2↑
(4)Na3AlF6
18. (每空2分,共6分)
⑴ Ag+、Ba2+、Al3+、
⑵ Na+、、
⑶ 加入盐酸,观察沉淀是否全部溶解
25.(16分)
(1)电解(2分)
|
(2) (2分)
(3)2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O(2分)
|
(4)2Cl-+2H2O 2OH-+H2↑+Cl2↑(2分)
2e-
| |||
(5)MnO2+4HCl MnCl2+2H2O+Cl2↑(用双线桥表示也可)(4分)
(6)用焰色反应检验Na+;(2分)用硝酸银和稀硝酸检验Cl-(2分
 题 号
题 号