提高练习
一、选择题
1.下列反应中盐酸为氧化剂的是( )
A.Zn+2HCl![]() ZnCl2+H2↑
ZnCl2+H2↑
B.CaCO3+2HCl![]() CaCl2+H2O+CO2↑
CaCl2+H2O+CO2↑
C.KClO3+6HCl![]() KCl+3Cl2↑+3H2O
KCl+3Cl2↑+3H2O
D.Ca(ClO)2+2HCl![]() CaCl2+2HClO
CaCl2+2HClO
解析:判断氧化剂、还原剂,要看反应物中有关元素的化合价变化情况。所含元素化合价反应后升高,该反应物为还原剂;物质中所含元素化合价降低,则该物质为氧化剂。
答案:A
2.下列制取单质的反应中,化合物作还原剂的是( )
A.Br2+2NaI![]() 2NaBr+I2
2NaBr+I2
B.Fe+H2SO4![]() FeSO4+H2↑
FeSO4+H2↑
C.2C+SiO2![]() Si+2CO
Si+2CO
D.2Al+Fe2O3![]() 2Fe十Al2O3
2Fe十Al2O3
答案:A
3.关于C1-和Cl2的说法正确的是( )
A.都能与Fe反应生成FeCl3
B.与AgNO3溶液反应都生成白色沉淀
C.均有毒
D.都具有氧化性
解析:Cl-的结构是最外层已达到8个电子的稳定结构,故无氧化性。Cl2与水反应生成HCl,能与AgNO3溶液反应产生AgCl白色沉淀。
答案:B
4.能使湿润的KI-淀粉试纸变蓝的是( )
①溴水 ②氯水 ③碘酒 ④氯化钾 ⑤高锰酸钾溶液
A.①②③
B.①⑤
C.①②③⑤
D.③④⑤
解析:单质碘可使淀粉试纸变蓝,故加入物质中如含有单质碘或能与KI反应生成单质碘,均可使湿润的KI——淀粉试纸变蓝。溴水和氯水中分别存在Br2、Cl2,可与KI反应置换出碘单质。碘酒是碘的酒精溶液,碘以I2分子形式溶解在酒精中。高锰酸钾溶液具有强氧化性,可将I-氧化生成I2单质。氯化钾不与KI反应,没有碘单质生成。
答案:C
5.下列反应中,属于有水参加的氧化还原反应且水只作氧化剂的是( )
A.SO2+H2O![]() H2SO3
H2SO3
B.Cl2+H2O![]() HCl+HClO
HCl+HClO
C.2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
D.3Fe+4H2O(气)![]() Fe3O4+4H2
Fe3O4+4H2
解析:判断一个反应是否为氧化还原反应,关键是看反应前后有没有化合价变化。氧化剂中有元素化合价降低。
答案:D
6.氢化钙中的氢元素为-1价,它可用作生氢剂,反应的化学方程式是CaH2+2H2O![]() Ca(OH)2+2H2↑。该反应中,水的作用是( )
Ca(OH)2+2H2↑。该反应中,水的作用是( )
A.溶剂
B.还原剂
C.氧化剂
D.既是还原剂又是氧化剂
解析:CaH2中氢元素为-1价,为最低价,具有还原性,化合价升高为0价,H2O中+1价氢只能降低,即显示氧化性。
答案:C
7.某元素在化学反应中由化合态变为游离态,则该元素( )
A.一定被氧化了
B.一定被还原了
C.既可能被氧化也可能被还原
D.既不可能被氧化,也不可能被还原
解析:某元素化合价既可能为负价,也可能为正价;若为负价则要被氧化为游离态,若为正价,则要被还原为零价。
答案:C
8.下列基本反应类型中,一定是氧化还原反应的是( )
A.化合反应
B.分解反应
C.置换反应
D.复分解反应
答案:C
二、填空题
9.H+、Cu、Mg、S2-、Zn、O2、SO2在化学反应中能失去电子的有_________,表现出_________性;能获得电子的有_________。表现出_________性;不同反应中,既能失去电子又能获得电子的有_________,表现_________性和_________性。
解析:能失去电子的粒子,在反应中可以作还原剂,显示还原性:一般元素化合价不处于最高价。元素化合价不是最低价,即能得电子,在反应中可作氧化剂,表现出氧化性。处于中间化合价的元素的原子,既可以失去电子显示还原性,又可以得到电子,表现出氧化性。
答案:Cu、Mg、S2-、Zn、SO2 还原性 H+、O2、SO2 氧化性 SO2 氧化性 还原性
10.在反应K2Cr2O7+14HCl![]() 2KCl+2CrCl3+3Cl2↑+7H2O中,_________是还原剂,_________元素被还原,还原剂共失去的电子数目为_________。
2KCl+2CrCl3+3Cl2↑+7H2O中,_________是还原剂,_________元素被还原,还原剂共失去的电子数目为_________。
答案:HCl Cr 6e-
11.从电子得失角度,用双线桥法分析下列氧化还原反应,并注明电子得失数目,指出氧化剂,还原剂。
①2Cl2+2Ca(OH)2![]() CaCl2+Ca(ClO)2+2H2O
CaCl2+Ca(ClO)2+2H2O
②MnO2+4HCl![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
③3NO2+H2O![]() 2HNO3+NO
2HNO3+NO
④FeSO4+Zn![]() ZnSO4+Fe
ZnSO4+Fe
解析:“双线桥”分析解答一般格式分为四步:一标出价态;二画好箭头;三写出“关系”;四指出“何剂”。
答案: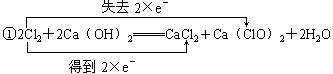
氧化剂:Cl2 还原剂:Cl2
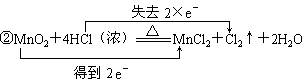
氧化剂:MnO2 还原剂:HCl
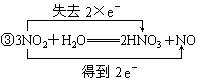
氧化剂:NO2 还原剂:NO2
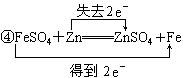
氧化剂:FeSO4 还原剂:Zn