高考化学考点精选测试题
(相对原子质量 H:1 C:12 Cu:64 Cu:64 Mg::24 Na:23
一、选择题(每小题1~2个正确选项):
1.下列晶体中,不属于原子晶体的是 ( )
A.干冰 B.水晶 C.晶体硅 D.金刚石
2.FeCl3溶液和Fe(OH)3胶体具有的共同性质是: ( )
A.滴人盐酸,先产生沉淀,然后沉淀又溶解 B.都能透过半透膜
C.都有丁达尔现象 D.加热蒸干灼烧,最终都有Fe2O3生成
3.已知充分燃烧a g乙炔气体时生成1 mol二氧化碳气体和液态水,并放出热量b kJ,则乙炔燃烧的化学方程式正确的是
A.![]() ;
;
![]()
B.![]() ;
;
![]()
C. ![]() ;
; ![]()
D.![]() ;
; ![]()
4.在下列有关晶体的叙述中错误的是 ( )
A.离子晶体中一定存在离子键 B.原子晶体中只存在共价键
C.原子晶体的熔沸点一定很高 D.稀有气体的原子能形成原子晶体
5.下列各组离子中,因发生氧化还原反应而不能大量共存的是 ( )
A.H+、Na+、S2O32-、Cl- B.Fe3+、Fe2+、SO42-、NO3-
C.Na+、OH-、SO42-、H2PO4- D.Cu2+、Na+、S2-、SO42-
6.某物质的晶体中含A、B、C三种元素,它的排列方式如图(其中前后两面心上的B原子末画出)晶体中A、B、C的原子个数比为 ( )
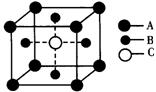
A.1:3:1 B.2:3:l C.1:2:1 D.1:3:3
7.根据反应(1)~(4),可以判断下列四种物质的氧化性由强到弱的正确顺序( )
(1)Cl2+2KI===2KCl+I2 (2)2FeCl2+Cl2===2FeCl3
(3)2FeCl3+2HI===2FeCl2+2HCl+I2 (4)H2S+I2=2HI+S
A.H2S>I2>Fe3+>Cl2 B.Cl2>Fe3+>I2>H2S
C.Fe3+>Cl2>H2S>I2 D.Cl2>I2>Fe3+>H2S
8.R2O8n-离子在一定条件下可以把Mn2+离子氧化成MnO4-,若反应后R2O8n-离子变为RO42-离子。 又知反应中氧化剂与还原剂的物质的量之比为5:2,则n的值是 ( )
A.1 B. 2 C.3 D.4
9.下列离子方程式正确的是
A.澄清石灰水与稀盐酸反应Ca(OH)2+2H+=Ca2++2H2O
B.钠与水反应Na+2H2O=Na++2OH-+H2↑
C.铜片插入硝酸银溶液中Cu+Ag+=Cu2++Ag
D.大理石溶于醋酸的反应CaCO3+2CH3COOH=Ca2++2CH3COO-+CO2↑+H2O
10.在pH=l的溶液中,可以大量共存的离子是
A.K+ Na+ ![]()
![]() B.
B.![]()
![]()
![]()
![]()
C.Na+ K+ ![]()
![]() D.K+ Na+
D.K+ Na+ ![]()
![]()
11.下列各组离子一定能大量共存的是
A.在含大量Fe3+的溶液中:NH4+、Na+、Cl—、SCN—
B.在强碱溶液中:Na+、K+、AlO2—、CO32—
C.在c(H+) =10—13mol/L 的溶液中:NH4+、Al3+、SO42—、NO3—
D.在pH =1的溶液中:K+、Fe2+、Cl—、NO3—
12.在相同的温度下,100g水最多能溶解Na2SO4 a g,最多能溶解Na2SO4·10H2O b g。则a与b的关系是
(A)a>b (B)a=b (C)a<b (D)无法确定
13.用Cu(OH)2胶体做电泳实验时,阴极附近蓝色加深,往此胶体中加入①硫酸镁溶液 ②硅酸胶体③氢氧化铁胶体④葡萄糖溶液时,不发生凝聚的是 (
)
A.①② B.②③ C.③④ D.①④
14.下列说法正确的是
( )
A.全部由非金属元素形成的化合物中只含有共价键
B.分子晶体的熔点较低,因为分子晶体中有化学键
C.金属在常温下都以晶体形成存在
D.金属晶体中,自由电子几乎均匀分布在整个晶体中,被许多金属离子共用
15.关于原电池和电解池的叙述正确的是 ( )
A.原电池中失去电子的电极为阴极
B.原电池的负极、电解池的阳极都发生氧化反应
C.原电池的两极一定是由活动性不同的两种金属组成
D.电解时电解池的阳极一定是阴离子放电
16.晶体硼的基本结构单元都是由硼原子组成的正二十面体的 原子晶体(如右图)。其中含20个等边三角形和一定数量的顶角,每个顶角上各有一个原子。试观察推断这个基本结构单元所含B原子数,B—B键个数及键角正确的一组是( )
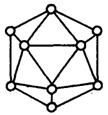 A.20个,60个,360° B.12个,30个,60°
A.20个,60个,360° B.12个,30个,60°
C.9个,18个,45° D.18个,54个,90°
17.已知如下两个热化学方程式
C(s)+O2(g)===CO2(g);△H==-393.5kJ/mol
2H2(g)+O2(g)===2H2O(g);△H===-483.6 kJ/mol
现有0.2mol炭粉和氢气组成的悬浮气体、固体混合物在氧气中完全燃烧,共放出63.53kJ热量。则炭粉与氢气的物质的量之比是 ( )
A.1:1 R l:2 C.2:3 D.3:2
18.1993年报导,合成了迄今为止世界上最大的烃,即C1134H1146。下列有关叙述正确的是 ( )
A.具有高硬度 B.属于高分子化合物
C.属于分子晶体 D.常温下呈固体
19.关于电解NaCI水溶液,下列叙述正确的是
A.电解时在阳极得到氯气,在阴极得到金属钠
B.若在阳极附近的溶液中滴人KI溶液,溶液呈棕色
C.若在阴极附近的溶液中滴人酚酞试液,溶液呈无色
D.电解一段时间后,将全部电解液转移到烧杯中,充分搅拌后落液呈中性
20.实验室将NaClO3和Na2SO3按物质的量之比为2:1倒入烧瓶中,同时滴入适量稀硫酸,并用水浴加热,产生棕黄色气体X,反应后测得NaClO3与Na2SO3恰好完全反应,则X为 ( )
A、Cl2 B、Cl2O C、ClO2 D、Cl2O3
高三化学答卷
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | A | D | A | D | A | A | B | B | D | B |
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 | B | C | C | D | B | B | A | CD | B | C |
20.(9分)(1)SiO2晶体中,1个Si原子可与__4____个O原子形成共价键。
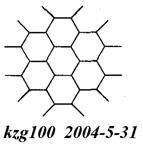
(2)右图为石墨的晶体结构俯视图。在石墨晶体中C原子数与C—C键数之比为_2:3__。
 (3)C100H120为含多个C≡C的链状化合物的分子式,该分子中含C≡C最多有___20___个。
(3)C100H120为含多个C≡C的链状化合物的分子式,该分子中含C≡C最多有___20___个。
21.(6分)在一定条件下,RO3n-和I-可以发生反应,离子方程式如下:
RO3n-+6I-+6H+===R-+3I2+3H2O
(1)RO3n-中R元素的化合价为__+5______
(2)R元素的原子核外最外层电子数为___7_____个。
22.(5分)将胶粒带负电荷的无色胶体,分别先后加入到1、蔗糖溶液2、氯化钙溶液3、Fe(OH)3胶体4、As2S3胶体,共出现三种现象:a、红褐色沉淀b、无沉淀c、白色沉淀。那么按实验的先后,出现的现象是 bcab 。
23.(16)电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
①电解池中X极上的电极反应式为 。在X极附近观察到的实验现象是 。
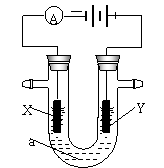 ②Y电极上的电极反应式为
。检验该电极反应产物的方法是
。
②Y电极上的电极反应式为
。检验该电极反应产物的方法是
。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
①X电极的材料是 ,电极反应式为 。
②Y电极的材料是 ,电极反应式为 。
(说明:杂质发生的电极反应不必写出)
⑴①2H+ + 2e - = H2↑ 放出气体,溶液变红。 ②2Cl - - 2e - = Cl2 ↑ 把湿润的碘化钾淀粉试纸放在Y电极附近,试纸变蓝色。⑵①纯铜 Cu2+ + 2e - = Cu ②粗铜Cu - 2e - = Cu2+
24.(8分)以两根铜棒作电极电解硫酸钠溶液。通电一段时间后,阴极上逸出amol气体,则此时溶液中减少的水质量为?烧杯中生成的氢氧化铜质量为?
将上题中两个铜电极改为铂电极,则减少的水质量为?
(1)36a g 98a g (2) 18a g
25.(6分)如图所示,直线交点处的圆圈为NaCl晶体中Na+离子或Cl-离子所处的位置。这两种离子在空间三个互相垂直的方向上都是等距离排列的。
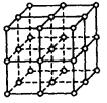 (1)晶体中,在每个Na+离子的周围与它最接近的且距离相等的Na+离子共有__12_个。
(1)晶体中,在每个Na+离子的周围与它最接近的且距离相等的Na+离子共有__12_个。
(2)已知食盐晶体的密度为2.2g/cm3,阿伏加德罗常数为6.02×1023mol-1。食盐晶体中两个距离最近的钠离子中心间的距离为4×10 -8______cm。(请写出计算过程)