高考化学规范训练五
第Ⅰ卷(选择题 共64分)
一、选择题:(本题包括6小题,每小题4分,共24分。每小题只有一个选项符合题意。)
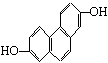
1、下列各组物质中必定属于同系物的是
A. ![]() B.
B.
![]()
C、CH2=CH2和CH2=CH—CH=CH2 D. ![]() 和
和![]()
2.下列各物质的名称正确的是 ( )
A.3,3-二甲基戊烷 B.2,3,3-三甲基丁烷
C.2,2-二甲基-3-乙基丁烷 D.2,3-二甲基-4-乙基己烷
3、分子中含有一个叁键的炔烃完全加氢后的产物结构如下
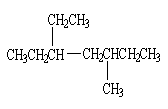 |
则该炔烃可能的结构有( )
A.1种 B.2种 C.3种 D.4种
4、 下列物质的沸点由高到低排列的顺序是 ① CH3(CH2)2CH3 ② CH3(CH2)3CH3
③ (CH3)3CH ④(CH3)2CHCH2CH3 ⑤ (CH3CH2)2CHCl
A、⑤②④①③ B、④②⑤①③ C、⑤④②①③ D、②④⑤③
5.线型弹性材料“丁苯吡橡胶”的结构简式如下:
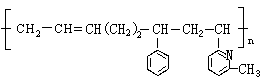
其单体可能是 ( )
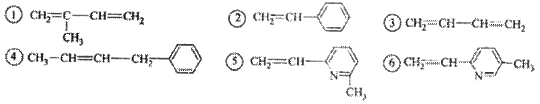
正确的组合是( )
A.②③⑥ B.②③⑤
C.①②⑥
D.②④⑥
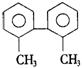 6.已知C—C键可以绕键轴自由旋转,结构简式为的烃,下列说法中正确的是
6.已知C—C键可以绕键轴自由旋转,结构简式为的烃,下列说法中正确的是
( )
A.分子中至少有8个碳原子处于同一平面上
B.分子中至少有9个碳原子处于同一平面上
C.该烃的一氯取代物最多有四种 D.该烃是苯的同系物
二、选择题(本题包括10小题,每小题4分,共40分;每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为O分,若正确答案包括两个选项,只选一个且正确得2分,多选、错选均不得分)
7、某卤代烷烃C5H11Cl发生消去反应时,可以得到两种烯烃,则该卤代烷烃的结构简式可能为( )
 A.CH3CH2CH2CH2Cl B.CH3CH2-CH-CH2CH3
A.CH3CH2CH2CH2Cl B.CH3CH2-CH-CH2CH3
C.CH3-CHCH2CH2CH3 D.CH3CH2C-CH3
8.用NA表示阿伏伽德罗常数,下列叙述中正确的是
A.在标准状态下,1L庚烷完全燃烧后,所生成的气态产物的分子数为![]() NA
NA
B.1mol碳正离子CH5+所含的电子数为10NA
C.标准状态下,16g甲烷完全燃烧所消耗的氧气的分子数为2NA
D.0.5molC3H8分子中含C-H共价键2NA
9.对于白磷引起的中毒,硫酸铜溶液是一种解毒剂,有关反应如下:
11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4
下列关于该反应的说法正确的是
A.CuSO4发生了氧化反应
B.生成1 mol H3PO4时,有10 mol电子转移
C.氧化产物和还原产物的物质的量之比为6∶5
D.白磷只作还原剂
10.常温下,下列各组离子在指定环境下能大量共存的是
A.pH=l的溶液中:Na+、K+、SO32-、MnO4-
B.pH=7的溶液中:Na+、A13+、Cl-、SO42-
C.pH>12的溶液中:Na+、K+、SO42-、AlO2-
D.pH=0的溶液中:Na+、K+、NO3-、ClO-
11.下列反应的离子方程式书写正确的是
A.小苏打溶液与氢氧化钠溶液反应:HCO3-+OH-=CO32-+H2O
B.NaHSO4溶液与Ba(OH)2溶液混合后显酸性:
Ba2++OH-+H++SO42-=BaSO4↓+H2O
C.氧化亚铁溶液中滴加稀硝酸:Fe2++NO3-+2H+=Fe3++NO↑+H2O
 D.偏铝酸钠水解:AlO2-+2H2O
D.偏铝酸钠水解:AlO2-+2H2O![]() Al(OH)3↓+OH-
Al(OH)3↓+OH-
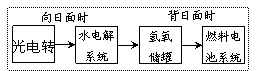
12.右图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH为电解液,下列有关说法中不正确的是
A.该能量转化系统中的水也是可以循环的
B.燃料电池系统产生的能量实际上来自于水
C.水电解系统中的阳极反应:4OH-―4e-=2H2O+O2↑
D.燃料电池放电时的负极反应:H2-2e-+2OH-=2H2O
13.将1molCH4和适量的氧气在密闭容器中点燃,充分反应后,甲烷和氧气均无剩余,且产物均为气体(101kPa,120℃),其总质量为72g,下列有关叙述不正确的是( )
A.若将产物通过碱石灰,则可全被吸收,若通过浓硫酸,则不能被完全吸收
B.产物的平均摩尔质量为24g/mol
C.若将产物通过浓硫酸充分吸收后恢复至(101kPa,120℃),则压强变为原来的1/3
 D.反应中消耗的氧气为56g
D.反应中消耗的氧气为56g
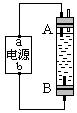
14.某学生设计了一种电解法制取Fe(OH)2的实验装置。通电后,溶液中产生大量白色沉淀,且较长时间不变色。下列说法中正确的是
A.电源中的a 为正极,b为负极
B.不能使用NaCl溶液作电解液
C.A、B两端都必须使用铁作电极
D.B电极发生的反应为2H2O+2e-=H2↑+2OH—
15.下列热化学方程式中△H的数值能表示可燃物燃烧热的是 ( )
A.CO(g)+![]() O2(g)=CO2(g);△H=-283kJ/mol
O2(g)=CO2(g);△H=-283kJ/mol
B.CH4(g)+2O2(g)=CO2(g)+2H2O(g);△H=-802.3kJ/mol
C.2H2(g)+O2(g)=2H2O(l);△H=-571.6kJ/mol
D.H2(g)+Cl2(g)=2HCl(g);△H=-184.6kJ/mol
16.用物质的量都是0.1molHCN和NaCN混合后配成1L溶液, 已知溶液中:
c(CN-)<c(Na+), 则下列关系式正确的是为
A.c(OH-)<c(H+) B.c(HCN)<c(CN-)
C.c(OH-)+c(CN-)=0.1mol/L D.c(CN-)+c(HCN)=0.2mol/L
第Ⅱ卷(非选择题 共86分)
三、(本题包括2小题,共20分)
17.(10分)一定温度下,将3 mol A和1 mol B气体通入一容积为2 L的密闭容器中,发生如下反应:3A(g) + B(g) ![]() xC(g),反应2 min后达到化学平衡状态(保持温度不变),此时测得容器中n(B) = n(C) = 0.8 mol。
xC(g),反应2 min后达到化学平衡状态(保持温度不变),此时测得容器中n(B) = n(C) = 0.8 mol。
请回答下列问题:
⑴ 从开始反应至达到平衡状态,物质C的平均反应速率为 , x= ;
⑵ 在保持温度不变的情况下,若向达平衡后的容器中通入a mol氦气(氦气和A、B、C都不反应),原平衡将________移动(选填“正向”、“逆向”或“不”);
⑶ 在保持温度不变的情况下,若向达平衡后的容器中再充入a mol C,原平衡混合物中B的体积分数将 (选填“增大”、“减小”或“不变”);
⑷ 如果上述反应在相同温度和容器中进行,欲使反应达到平衡时C的体积分数与原平衡相同,则起始时加入的三种物质的物质的量n(A)、n(B)、n(C)之间应该满足的关系为
[请写出一个同时含有n(A)、n(B)、n(C)的关系式]。
18.(10分)下图表示各物质之间的转化关系。已知:常温下D、E、F、I、J为气体,且D、I是水煤气的主要成分;B是无色液体,M为红褐色固体,C的焰色反应为黄色。
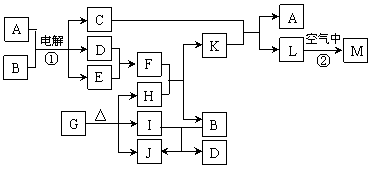 |
⑴基于反应①原理的化学工业称为 ,写出该反应的化学方程式 。
⑵写出K和E反应的离子方程式_______________________________________。
写出F溶液和H反应的离子方程式___________________________________。
⑶已知:由G分解得到的H、I、J三者的物质的量之比为1∶1∶1,则G的化学式为_____________。
四、(本题包括2小题,共22分)
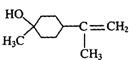
19.(10分)松油醇是一种调香香精,它是α、β、γ三种同分异构体组成的混合物,可由松节油分馏产品A(下式中的18是为区分两个羟基而人为加上去的)经下列反应制得:
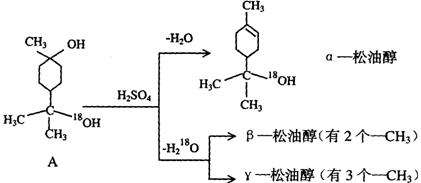
(1)α-松油醇的分子式
(2)α-松油醇所属的有机物类别是 (多选扣分)
(a)醇 (b)酚 (c)饱和一元醇
(3)α-松油醇能发生的反应类型是 (多选扣分)
(a)加成 (b)水解 (c)氧化
(4)写结构简式:β-松油醇 ,γ松油醇 。
20.(12分)1922年的诺贝尔化学奖为提出应用质子核磁共振谱(PMR)研究有机物结构的科学家所获得。1991年和2002年两年的诺贝尔化学奖即为应用此项技术在有机物结构研究领域有重大发现的几位科学家获得。有机分子中,不同氢原子在PMR中对应不同的峰(信号),且峰的强度与分子中同类氢原子个数成正比。例如丙烷分子有两种不同的H(甲基中的H和亚甲基中的H),PMR有两个峰,且两个峰的强度比为6∶2(或写成3∶1,前者为甲基上氢对应的峰,后者为亚甲基上氢对应的峰);同理,甲醇分子的PMR有两个峰,且强度比为3∶1。
|
⑴ 乙烷分子的PMR有 个峰; 分子的PMR有 个峰。
⑵ 在运用PMR谱确定C2H6O结构时,在核磁共振谱上给出的峰有两组,其中一组只有一个信号峰,该组信号峰对应物质的结构简式为 ,另一组有三个信号峰,则三个信号峰的强度比为 。
⑶ 化学式为C6H14的物质有多种,其中有一种在核磁共振谱上的信号峰有5个,该物质的结构简式为 ,另有一种在核磁共振谱上的信号峰只有2个,该物质名称为 。
五、(本题包括2小题,共17分)
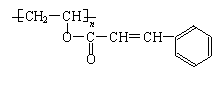 21.(9分)感光性高分子又称“光敏高分子”,是一种在彩色荧屏及大规模集成电路制造中
21.(9分)感光性高分子又称“光敏高分子”,是一种在彩色荧屏及大规模集成电路制造中
应用较广的新型高分子材料。其结构简式为:
试回答下列问题:
⑴在一定条件下,该高聚物可发生的反应有(填编号)_______________;
①加成反应 ②氧化反应 ③消去反应 ④酯化反应 ⑤卤代反应
⑵该高聚物在催化剂的作用下,水解后得到相对分子质量较小的产物A,则
①A的分子式是___________________;
②A在一定条件下与乙醇反应的化学方程式是_________________________________;
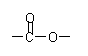 |
![]() ③A的同分异构体有多种,其中含有苯环、 、
,且苯环上有两个对位取代基的结构简式是
③A的同分异构体有多种,其中含有苯环、 、
,且苯环上有两个对位取代基的结构简式是
____________________________________________________________________。
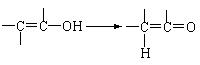 22.(8分)通常羟基与烯键碳原子相连接时,易发生下列转化:
22.(8分)通常羟基与烯键碳原子相连接时,易发生下列转化:
已知:有机物A是由C、H、O三种元素组成,原子个数比为2∶3∶1,其蒸气密度为相同状况下H2密度的43倍,E能与NaOH溶液反应,F转化为G时,产物只有一种结构,且G能使溴水褪色,现有下图所示的转化关系:
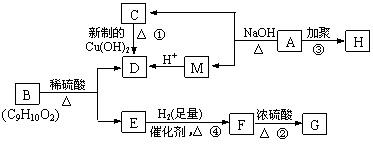 |
回答下列问题:
⑴写出下列反应的基本类型:②_____________________ ④______________________
⑵写出下列化学方程式:
反应①:___________________________________________________________。
反应②:___________________________________________________________。
反应③:___________________________________________________________。
六、(本题包括1小题,共13分)
23、(13分)已知连接羟基的碳原子上没有氢原子的醇不能发生催化氧化反应。A是一种重要的化工原料,其分子组成为C4H9Cl,A有如下转化关系:
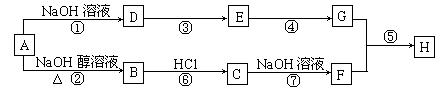
其中F不能发生催化氧化反应,E和G都能和新制Cu(OH)2反应,但反应条件实验现象不同,H是一种有果香味的液体。
(1) A的同分异构体有_____种,符合条件的结构简式为_______________。
(2) 与①、⑦反应类型相同的是_______(填序号,后同),若A中混有C,则对生成的B的纯度是否有影响______(填“是”或“否”),理由是_________。
(3) 写出下列反应的化学方程式:
D→E:_______________________________________________;
G+F→H:___________________________________________。
七、(本题包括两小题,共14分)
24.(6分)标准状况下,取22.4L由两种气态烃组成的混合物在足量O2中充分燃烧后再冷却到标准状况,生成4.48L二氧化碳和3.6g水,试求这两种烃可能的分子式。
25.(8分)常温下电解200 mL 一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如下图所示(气体体积已换算成标准状况下的体积),根据图中信息回答下列问题。
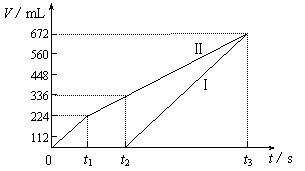 |
⑴通过计算推测:
①原混合溶液NaCl和CuSO4的物质的量浓度。
②t2时所得溶液的pH。
⑵实验中发现,阳极产生的气体体积与阴极相比,明显小于对应时间段的理论值。试简要分析其可能原因。
参考答案
1.B 2.D 3.B 4.A 5.B 6.B 7.CD 8.BC 9.C 10.C 11.AD 12.B 13.AB 14.AD 15.A 16.D
17.(10分)
⑴ 0.2 mol·(L·min)-1 4 ⑵ 不 ⑶ 不变
⑷ [n (A)+![]() n (C) ] :
[n (B)+
n (C) ] :
[n (B)+![]() n (C)
] = 3 : 1
(每空2分
n (C)
] = 3 : 1
(每空2分
18.⑴氯碱工业
2NaCl+2H2O![]() H2↑+C12↑+2NaOH
H2↑+C12↑+2NaOH
⑵2Fe2++Cl2=2Fe3++2Cl— FeO+2H+=Fe2++H2O
⑶FeC2O4 (每空2分,共10分)
19.(1)C10H1818O(2分)
(2)a(2分)
(3)a、c(2分)
(4) 、
、![]() (4分)
(4分)
20.⑴ 1 5 (每个2分,共4分)
⑵ CH3OCH3 1∶2∶3 (每个2分,共4分)
⑶ 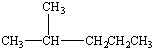 2,3-二甲基丁烷 (每个2分,共4分)
2,3-二甲基丁烷 (每个2分,共4分)
21.⑴①②⑤ ⑵C9H8O2
②
 |
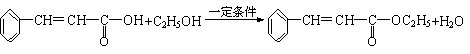
22.(10分)⑴消去反应,加成反应
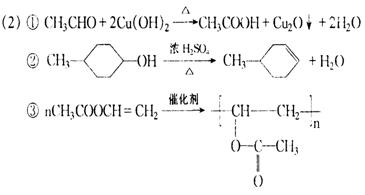
23、(1)4(2分),(CH3)2CHCH2Cl(2分)
(2)⑤(2分),否(1分)
![]() A、C的消去反应产物相同(A、C的消去反应产物均为(CH3)2C=CH2)(2分)
A、C的消去反应产物相同(A、C的消去反应产物均为(CH3)2C=CH2)(2分)
 (3) (CH3)2CHCH2OH+O2 (CH3)2CHCHO+2H2O(2分)
(3) (CH3)2CHCH2OH+O2 (CH3)2CHCHO+2H2O(2分)
CH3CH(CH3)COOH+(CH3)3COH CH3CH(CH3)COOC(CH3)3+H2O(2分)
24.(6分)CH4与 C3H4;C2H2与 C2H6;*CH4与 C4H4
25.(8分)⑴①阳极首先逸出的是Cl2
n(NaCl)=2n(Cl2)=0.02 mol
则c(NaCl)=0.1mol/L (3分)
阳极得到336 mL气体中,含0.01 mol Cl2和0.005 mol O2
转移电子的物质的量为:0.01 mol×2+0.005 mol×4=0.04 mol
此过程中阴极刚好全部析出铜
n(CuSO4)=n(Cu)=0.04 mol÷2=0.02 mol
则c(CuSO4)=![]() =0.1mol/L (3分)
=0.1mol/L (3分)
②t2时溶液中c(Na+)=0.1 mol/L,c(SO42-)=0.1 mol/L
根据电荷守恒有:c(H+)=2×0.1 mol/L-0.1 mol/L=0.1 mol/L
即溶液的pH=1 (2分)
⑵产生的氯气和氧气在水中的溶解度明显大于氢气(2分)