高考化学规范练习六
第Ⅰ卷(选择题 共64分)
一、选择题:(本题包括6小题,每小题4分,共24分。每小题只有一个选项符合题意。)
1.“神舟六号”的成功发射和返回,第一次实现了我国有人参与的空间科学实验。整个飞船应用了许多尖端的合成材料。下列物质中,不属于合成材料的是
A.人造丝 B.有机玻璃 C.硅橡胶 D.黏合剂
2.物质世界中有很多变化是由物理变化造成的。以下变化或过程就属于物理变化的是
A.激光法蒸发石墨得C60 B.渗析法净化氢氧化铁胶体
C.鸡蛋白遇浓硝酸显黄色 D.直流电通过氯化钠水溶液
3.向淀粉中加入少量稀H2SO4,并加热。为了确定淀粉是否已水解或完全水解,所需下列试剂是 ①NaOH溶液 ②银氨溶液 ③新制Cu(OH)2碱性悬浊液 ④碘水 ⑤BaCl2
A.①⑤ B.②④ C.②③④ D.①③④
4.下列取代基或微粒中,碳原子都满足最外层为8电子结构的是
A.乙基(—CH2CH3) B.碳正离子[(CH3)3C⊕]
C.乙醛 (CH3CHO) D.碳烯 (:CH2)
5.下列有关比较中,大小顺序排列错误的是
A.物质的熔点:石英>食盐>冰>汞
B.热稳定性:PH3>H2S>HBr>NH3
C.结合质子的能力:CO32—>CH3COO->SO42—
D.分散系中分散质粒子的直径:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液
6.X、Y、Z均为短周期元素,其中X元素是地壳中含量最高的元素。Y、Z同周期, Y的族序数比Z小4,而Z的单质分子中含34个电子。有关下列叙述中错误的是
A.X、Y、Z简单离子半径大小为Z>Y>X
B.常温下,Y与Z形成的化合物水溶液pH<7
C.X元素可形成两种常见同素异形体
D.X与Y形成的化合物具有两性
二、选择题(本题包括10小题,每小题4分,共40分;每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为O分,若正确答案包括两个选项,只选一个且正确得2分,多选、错选均不得分)
7.常温时,将Vl mL cl mol·L-1的氨水滴加到V2 mL c2 mol·L-1的盐酸中,下列叙述正确的是
A.若clVl =c2V2,则所得混合液的pH=7
B.若混合液的pH=7,则混合液中c(NH4+)=c(Cl-)
C.若clVl >c2V2,则混合液中可能呈酸性、中性或碱性
D.若Vl=V2,且混合液的pH<7,则一定有cl<c2
8.不久前美国M-C Power 公司已在加州圣迭戈的海军航空站安装了一台250kW装置的MCFC型燃料电池,该电池的工作温度为600℃~700℃,用H2为燃料,以熔融的K2CO3为电解质,它工作时能同时供应电和水蒸气。已知该电池的总反应方程式与H2燃烧的化学方程式相同,负极反应为:H2+CO32--2e-=H2O+CO2。则下列推断正确的是
A.正极反应为:O2+2CO2+4e-=2CO32-
B.放电时CO32-向正极迁移
C.放电时装置中的CO32-不断减少
D.当转移4×104mol电子时,理论上电池最多只能供应104mol水蒸气
9.两种气态烃以任意比例混合,在120℃时1 L该混合烃与4 L氧气混合,电火花点燃充分反应后恢复到原状况,所得气体体积为5 L。下列各组混合烃中一定符合此条件的是
A.CH4、C2H6 B.C2H2、C2H6 C.CH4、C2H4 D.C3H4、C4H4
10.下列各组离子在相应的条件下可以大量共存的是
A.在碱性溶液中:CO32—、K+、C1—、Na+
B.与铝粉反应放出氢气的无色溶液中:NO3—、Mg2+、Na+、SO42—
C.在c(H+)/c(OH—)==1×1013的溶液中:NH4+、Ca2+、C1—、K+
D.在中性溶液中:Fe3+、S2—、NO3—、A13+
11.几种短周期元素的原子半径及主要化合价如下表:
| 元素代号 | W | R | X | Y | Z |
| 原子半径/nm | 0.099 | 0.102 | 0.074 | 0.075 | 0.077 |
| 主要化合价 | -1、+7 | -2、+6 | -2 | -3,+5 | +2、+4 |
![]()
![]() 下列叙述正确的是
下列叙述正确的是
A.Z与X可形成ZX 、Z2X 等阴离子
B.R的氢化物的沸点高于X的氢化物的沸点
C.R的气态氢化物的稳定性强于W的气态氢化物
D.Z分别与X、R、W均可形成非极性分子的化合物
12.下列反应的离子方程式正确的是
A.将铜片投入足量稀硝酸:Cu+NO3—+4H+==Cu2++NO↑+2H2O
B.草酸和少量烧碱溶液:H2C2O4+OH—==HC2O4—+H2O
C.苯酚钠溶液中通入少量二氧化碳:2C6H5O—+CO2===2C6H5OH+CO32—
![]() D.实验室制备氢氧化铁胶体:Fe3++3H2O
Fe(OH)3(胶体)+3H+
D.实验室制备氢氧化铁胶体:Fe3++3H2O
Fe(OH)3(胶体)+3H+
![]() 13.咖啡酸具有止血、镇咳、祛痰等疗效,其结构简式为
。下列有关咖啡酸的说法中,不正确的是
13.咖啡酸具有止血、镇咳、祛痰等疗效,其结构简式为
。下列有关咖啡酸的说法中,不正确的是
A.咖啡酸分子中的所有原子可能共平面
B.咖啡酸可以发生还原、酯化、加聚、显色等反应
C.1 mol咖啡酸可与4 mol Br2发生反应
D.1 mol咖啡酸与NaOH溶液反应最多消耗1 mol的NaOH
14.阿伏加德罗常数约为6.02×1023 mol—1,下列说法正确的是
A.常温下,l mol氯气与熟石灰完全反应转移电子数为2×6.02×1023
B.44g二氧化碳中含有的共用电子对数目为2×6.02×1023
C.标准状况下,22.4L 甲醛所含的分子数约为6.02×1023
D.常温常压下,20g重水(D2O)所含的中子数为8×6.02×1023
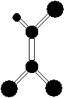 15.据调查,劣质的家庭装饰材料会释放出近百种能引发疾病的有害物质,其中一种有机物分子的球棍模型如右图,图中“棍”代表单键、双键或三键,不同大小的球代表不同元素的原子,且三种元素位于不同的短周期。下面关于该物质的叙述正确的是
15.据调查,劣质的家庭装饰材料会释放出近百种能引发疾病的有害物质,其中一种有机物分子的球棍模型如右图,图中“棍”代表单键、双键或三键,不同大小的球代表不同元素的原子,且三种元素位于不同的短周期。下面关于该物质的叙述正确的是
A.有机物化学式为C2HCl3
B.该分子为非极性分子
C.该有机物难溶于水
D.可由乙炔和氯化氢加成得到
16、密闭容器A、B,A中通入1molN2、3molH2,B中通入
0.5molN2、1.5molH2,反应一段时间后,A、B中均达到平衡状态。下列判断正确的是
A.A中吸热92.4kJ B.B中放热46.2kJ
C.A中热量变化值大于B中的2倍 D. A中热量变化值等于B中的2倍
第Ⅱ卷(非选择题 共86分)
三、(本题包括3小题,共28分)
17.(6分)实验室有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验,请完成下列填空
取20.00 mL待测稀盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的标准NaOH溶液进行滴定。重复上述滴定操作2~3次,记录数据如下:
| 实验 编号 | NaOH溶液的浓 度(mol·L-1) | 滴定完成时滴入NaOH溶液的体积(mL) | 待测盐酸溶液的体积(mL) |
| 1 | 0.10 | 22.62 | 20.00 |
| 2 | 0.10 | 22.72 | 20.00 |
| 3 | 0.10 | 23.80 | 20.00 |
①滴定达到终点的标志是__________________________________________________。
②根据上述数据,可计算出该盐酸的物质的量浓度约为_______(保留两位有效数字)。
 ③排去碱式滴定管中气泡的方法应采用操作______,然后轻轻挤压玻璃球使尖嘴部分充满碱液。
③排去碱式滴定管中气泡的方法应采用操作______,然后轻轻挤压玻璃球使尖嘴部分充满碱液。
| |
④在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有_________。(多选扣分)A.滴定终点读数时俯视读数
B.酸式滴定管使用前,水洗后未用待测盐酸润洗
C.锥形瓶水洗后未干燥
D.称量前NaOH固体中混有Na2CO3固体
E.配制好的NaOH标准溶液保存不当,部分与空气中的CO2反应生成了Na2CO3
F.碱式滴定管尖嘴部分有气泡,滴定后消失
18.(8分)为防止碘缺乏病,,通常在食盐中加入KIO3。
⑴用淀粉碘化钾溶液和稀硫酸可定性检验出食盐中的IO3-,表示该反应的离子方程式是____________________________________,若要确认食盐中还含有K+,方法是____
__________________________________________________________________________。
⑵工业上以石墨和铁为电极电解KI溶液制取KIO3。电解时,石墨作_________(填“阳极”或“阴极”),石墨电极上的电极反应式是____________________________,电解过程中铁电极附近溶液pH__________(填“变大”、“变小”或“不变”)。
19.(14分)Ⅰ.课本中介绍了乙醇氧化的实验:把一端弯成螺旋状的铜丝放在酒精灯外焰加热,待铜丝表面变黑后立即把它插入盛有约2 mL乙醇的试管里,反复操作几次。注意闻生成物的气味,并观察铜丝表面的变化。
⑴实验室可采用化学方法替代“闻生成物的气味”,写出该化学方法的化学反应方程式 。
⑵某同学在探究“闻生成物的气味”的替代方法时,偶然发现向溴水中加入乙醛溶液,溴水褪色。该同学为解释上述现象,提出两种猜想:①
溴水将乙醛氧化为乙酸;
② 溴水与乙醛发生加成反应。请你设计一个简单的实验,探究哪一种猜想正确?
。
![]()
 Ⅱ.某课外活动小组利用下图装置进行乙醇的催化氧化实验并制取乙醛(试管丙中用水吸收产物),图中铁架台等装置已略去。实验时,先加热玻璃管中的铜丝,约1min后鼓入空气。请填写下列空白:
Ⅱ.某课外活动小组利用下图装置进行乙醇的催化氧化实验并制取乙醛(试管丙中用水吸收产物),图中铁架台等装置已略去。实验时,先加热玻璃管中的铜丝,约1min后鼓入空气。请填写下列空白:
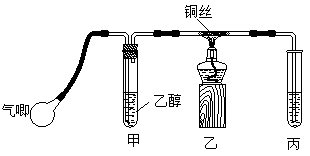 |
⑴乙醇发生催化氧化的化学反应方程式为____________________________________。
⑵实验时,常常将甲装置浸在70℃~80℃的水浴中,目的是____________________;由于装置设计上的缺陷,实验进行时可能会 。
⑶反应发生后,移去酒精灯,利用反应自身放出的热量可维持反应继续进行。进一步研究表明,鼓气速度与反应体系的温度关系曲线如图所示。试解释鼓气速度过快,反应体系温度反而下降的原因: ;你认为该实验中“鼓气速度”这一变量可用 来计量。
四、(本题包括2小题,共20分)
20.(8分) A、B、C、D、E都是元素周期表中前20号的元素,原子序数依次增大,B、C、、D同周期,A、D同主族,E和其它元素既不在同周期也不在同主族,B、C、D的最高价氧化物的水化物两两混合均能发生反应生成盐和水。A和E可组成离子化合物,其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如下图所示,阳离子(用“●”表示)位于该正方体的顶点或面心;阴离子(用“○”表示)位于小正方体的中心。
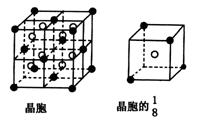 根据以上信息,回答下列问题:
根据以上信息,回答下列问题:
(1)比较A和D的氢化物,后者的沸点较低,其原因是 ;
(2) B的离子结构示意图为 。元素C在元素周期表中的位置是 ;
(3) A和E形成的化合物的电子式是 。
21.(12分)A~N均为中学化学中的常见物质,其中A是日常生活中不可缺少的物质,也是化工生产上的重要原料,单质M是目前使用量最大的金属,常温下B、E、F为气体,G为无色液体,这些物质在一定条件下存在如下转化关系,其中有些反应物或生成物已经略去。
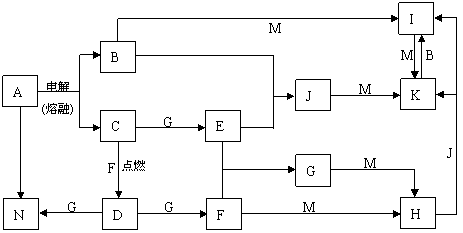 |
回答下列问题:
⑴H的化学式为__________,D的电子式为__________。
⑵工业上用A制取N的化学反应方程式为____________________________________。
⑶D与G反应的离子方程式为_______________________________________。
⑷I的浓溶液滴入沸水中反应的离子方程式为___________________________________。
⑸G与M反应的化学方程式为 。在一定条件下该反应也可以向相反的方向进行,请判断该反应与上述转化是否矛盾并说明理由________________________________________________________________________
__________________________________________________。
五、(本题包括2小题,共20分)
22.(10分) A是一种含碳、氢、氧三种元素的有机化合物,已知:A相对分子质量为144,其中碳的质量分数为50%。A可以使溴水褪色。A难溶于水,但在酸性条件下可发生水解反应,得到B和甲醇。B中碳、氢、氧原子个数比为1:1:1,分子中没有支链,能与氢氧化钠溶液发生反应。
(1)A可以发生的反应有 (选填编号)
① 加成反应 ② 酯化反应 ③ 加聚反应 ④ 氧化反应
(2)B分子所含官能团的名称是 、 。
(3)与B具有相同官能团的同分异构体的结构简式是 。
(4)由B制取A的化学方程式是: 。
23.(10分)以石油裂解得到的乙烯和1,3-丁二烯为原料,经过下列反应合成高分子化合物H,该物质可用于制造以玻璃纤维为填料的增强塑料(俗称玻璃钢)。
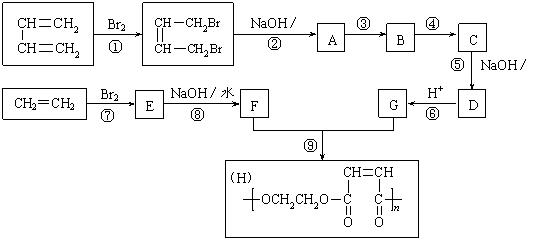
请按要求填空:
⑴写出下列反应的反应类型:
反应①________________,反应⑤________________,反应⑧________________。
⑵反应②的化学方程式是______________________________________________。
⑶反应③、④中有一反应是与HCl加成,该反应是________(填反应编号),设计这一步反应的目的是_________________________________________________,物质C的结
构简式是_______________________。
六、(本题包括1小题,共6分)
24.(6分)将4 mol SO3气体和4 mol NO置于2 L容器中,一定条件下发生如下可逆反应(不考虑NO2和N2O4之间的相互转化):2SO3(g) ![]() 2SO2+O2、2NO+O2
2SO2+O2、2NO+O2 ![]() 2NO2
2NO2
⑴当上述系统达到平衡时,O2和NO2的物质的量分别为n(O2)=0.1 mol、n(NO2)=3.6 mol,则此时SO3气体的物质的量为 。
⑵当上述系统达到平衡时,欲求其混合气体的平衡组成,则至少还需要知道两种气体的平衡浓度,但这两种气体不能同时是SO3和 ,或NO和 (填它们的分子式)。
⑶在其它条件不变的情况下,若改为起始时在1 L容器中充入2 molNO2和2 molSO2,则上述两反应达到平衡时,c (SO2)平= mol/L。
七、(本题包括两小题,共12分)
24.(6分)在稀硫酸溶液中,4.48g Cu2S和CuS的混合物与100mL 0.75mol·L-1的MnO4-反应生成了SO42-、Cu2+和Mn2+。剩余的MnO4-恰好与35.0mL 1.00mol·L-1 FeSO4溶液反应。
(1)配平下列反应化学方程式:
____Cu2S+____ MnO4-+____H+===____ Cu2++____SO42-+____ Mn2++____H2O
(2)试计算原始混合物中Cu2S的质量分数。
25.(6分)已知由硝酸银和硝酸铜组成的100mL混合溶液中,c(NO3-)=2mol/L。现往其中加入一定量的铝粉,充分反应后过滤,将滤纸上的沉淀干燥后称重为12.4g。将此沉淀加入稀盐酸中无气体产生。滤液中滴入NaCl溶液无现象。后加入过量的稀NaOH溶液得到沉淀。过滤、加热、冷却、称重为2g。
求:(1)原混合溶液中硝酸银和硝酸铜的物质的量之比。
(2)参加反应的铝的质量。
参考答案
1.A 2.B 3.D 4.C 5.B 6.A 7.BC 8.A 9 C 10.AC 11.A D12.B 13.D 14.C 15.AC 16.C
17.(6分)
①加入最后一滴NaOH溶液时,锥形瓶中溶液由无色恰好变成浅红色,且30s内不变色(1分) ②0.11 mol·L-1 (2分) ③丙(1分) ④DF(2分)
18.⑴IO3-+5I-+6H+=3I2+3H2O 取食盐做焰色反应实验,若透过蓝色钴玻璃观察焰色呈紫色,说明有K+(答取上述反应后溶液进行实验不给分) (4分)
⑵阳极 I-+3H2O-6e-=IO3-+6H+ 变大
19.Ⅰ.⑴CH3CHO+2[Ag(NH3)2]OH![]()
![]() CH3COONH4+2Ag+3NH3+H2O
CH3COONH4+2Ag+3NH3+H2O
或CH3CHO+2Cu(OH)2
![]() CH3COOH+Cu2O(红色)↓+2H2O
CH3COOH+Cu2O(红色)↓+2H2O
⑵用pH试纸检测溴水与褪色后溶液的酸碱性。若酸性明显增强,则猜想①正确;反之,猜想②正确(或其他合理答案)
Ⅱ.⑴2CH3CH2OH+O2![]()
![]() 2CH3CHO+H2O
2CH3CHO+H2O
⑵使生成乙醇蒸汽的速率加快 发生倒吸现象,导致玻璃管破裂
⑶过量的气体将体系中的热量带走 单位时间内甲中的气泡数(每空2分,共14分)
20.(8分)(1)由于HF分子间存在氢键,所以HCl比HF熔点低。(2)Na+的结构示意图略;第三周期,第ⅢA族(3)CaF2电子式略
21.⑴Fe3O4(1分) Na+[![]() ]2-Na+(1分) ⑵2NaCl+2H2O
]2-Na+(1分) ⑵2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑(2分)
2NaOH+H2↑+Cl2↑(2分)
⑶2Na2O2+2H2O=4Na++4OH-+O2↑(2分) Fe3++3H2O![]() Fe(OH)3(胶体)+3H+(2分)
Fe(OH)3(胶体)+3H+(2分)
⑸4H2O+3Fe![]() Fe3O4+4H2(2分) 不矛盾。铁和水蒸气生成四氧化三铁和氢气的反应为可逆反应,在一定温度下,当不断通入水蒸气时,反应向生成四氧化三铁的方向进行;当不断通入氢气时,反应向生成铁的方向进行,所以上述反应不矛盾。(2分)
Fe3O4+4H2(2分) 不矛盾。铁和水蒸气生成四氧化三铁和氢气的反应为可逆反应,在一定温度下,当不断通入水蒸气时,反应向生成四氧化三铁的方向进行;当不断通入氢气时,反应向生成铁的方向进行,所以上述反应不矛盾。(2分)
22.(10分)⑴ ①③④
⑵ 碳碳双健 羧基
⑶ HOOCCH=CHCOOH CH2=C(COOH)2
⑷ HOOCCH=CHCOOH + 2CH3OH ![]() CH3OOCCH=CHCOOCH3
+ 2H2O
CH3OOCCH=CHCOOCH3
+ 2H2O
23.⑴加成反应 消去反应 取代反应 (3分)
⑵![]() +2NaOH→
+2NaOH→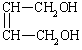 +2NaBr (2分)
+2NaBr (2分)
⑶ ③ 保护A分子中C=C不被氧化 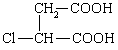
21.⑴0.2 mol ⑵SO2、NO2 ⑶1.9 (每小题2分,共6分)
25.(6分)(1)Cu2S+2 MnO4-8H+==2Cu2++SO42-+2Mn2++4H2O(2分)
(2)35.7%(4分)
25.(8分)
|
解之得:x=0.1 y=0.05 (1分)
x:y=2:1 即硝酸银和硝酸铜的物质的量之比为2:1
(2)参加反应的铝的质量为W
根据得失电子数相等可得:x+2(y-![]() )=
)= ![]() ×3 (3分)
×3 (3分)
代入x、y,可求得W=1.35(g) (1分)
参加反应的铝的质量为1.35g