高考化学模拟调研测试卷
高三化学
可能用到的相对原子质量: H一l Si一28 S一32 Cl一35 . 5 Fe一56
C一12 N一14 O一16 Na一23 Cu—64 Ba一137 Al一27
第 I 卷(选择题,共 48 分)
一、单项选择题(本题包括 8 小题,每小题 4 分,共 32 分。每小题只有一个选项符合题意)
 1.2007 年诺贝尔化学奖授予德国化学家 GerhardErtl ,以表彰他对固体表面化学过程研究的重大发现。使 CO、NOx等在铂表面发生化学反应转变成无毒气体,以减少汽车尾气中有毒气体的排放,正是此项研究的重要应用之一。下列有关说法不正确的是
1.2007 年诺贝尔化学奖授予德国化学家 GerhardErtl ,以表彰他对固体表面化学过程研究的重大发现。使 CO、NOx等在铂表面发生化学反应转变成无毒气体,以减少汽车尾气中有毒气体的排放,正是此项研究的重要应用之一。下列有关说法不正确的是
A.CO在铂表面被氧化生成CO2
B.汽车尾气中NOx在铂表面反应转化为N2
C.CO在铂表面可与O2、NOx反应
D.铂在反应中起氧化作用
2.正确掌握化学用语是学好化学的基础。下列化学用语中正确的是
A.乙烯的结构简式为CH2CH2 B.葡萄糖的实验式(最简式)为 C6H12O6 。
C.Ca2+的结构示意图为![]() D .NH4Cl的电子式为
D .NH4Cl的电子式为![]()
3.下列说法中,不正确的是
A.硅、二氧化硅、硅酸钠是工业上制造光导纤维的主要原料
B.氯水、二氧化硫、过氧化钠均可作漂白剂
C.浓硫酸、硅胶、碱石灰常用作干燥剂
D.氧化铝、碳酸氢钠、氨基乙酸既可与盐酸反应又能与氢氧化钠溶液反应
4.阿伏加德罗常数为6.02 xl023 mol—1,下列说法中正确的是
A.1 mol乙烷中含有C一H的键数为7x6.02x l023 mol—1
B.1 mol甲基(一CH3)所含电子数为9 xl023 mol—1
C.标准状况下,11.2L 四氯化碳所含分子数为0.5 xl023 mol—1
D.5.6g铁与足量氯气反应,转移的电子数为0.2 xl023 mol—1
5.为提纯下列物质(括弓内为杂质),选用的除杂试剂和分离方法都正确的是
| 物质 | 除杂试剂 | 分离方法 | |
| A | 二氧化硅(碳酸钙) | 氢氧化钠 | 重结晶 |
| B | 硫酸铜溶液(硫酸铁) | 加入过量铜粉 | 过滤 |
| C | 乙醇(乙酸) | 生石灰 | 蒸馏 |
| D | 苯(苯酚) | 浓澳水 | 分液 |
6.下列溶液中,能大量共存的离子组是
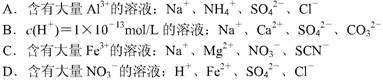
7 .下列装置所示的实验中,能达到实验目的的是
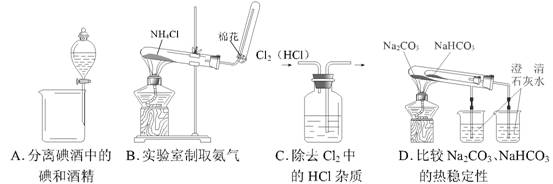
8 .甲乙两位同学一起做水果电池的实验,测得数据如下:
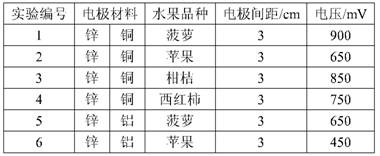
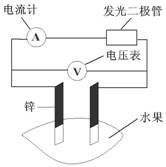
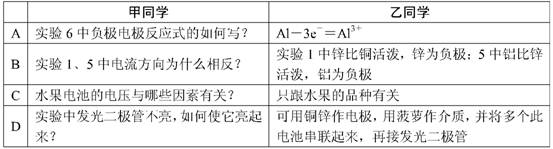
甲同学提出的问题,乙同学解释不正确的是
二、选择题(本题包括 6 小题,每小题 4 分,共 24 分。每小题有一个或二个选项符合题意。若正确答案包括一个选项,多选时,该小题得 0 分;若正确答案包括两个选项,只选一个且正确的得 2 分,选两个且都正确的得满分,但只要选错一个,该小题就得 0 分)
9.X、Y、Z、W为四种短周期主族元素。其中X、Z同族,Y、Z同周期,W与X、Y既不同族也不同周期;X原子最外层电子数是核外电子层数的3倍;Y的最高正价与最低负价的代数和为6 。下列说法正确的是
A.Y 元素最高价氧化物对应水化物的化学式为H2YO4
B.原子半径有小到大的顺序为:W < X < Z
C.X与W 可以形成W2X、W2X2两种物质
D.Y、Z两元素的气态氢化物中,Z的气态氢化物最稳定
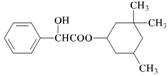 10.环扁桃醋具有松弛血管平滑肌,扩张血管的功能,其结构简式如下图。下列对该物质叙述中,正确的是
10.环扁桃醋具有松弛血管平滑肌,扩张血管的功能,其结构简式如下图。下列对该物质叙述中,正确的是
A.该物质属于芳香烃
B.该有机物难溶于水
C.分子式为C17H23O3
D.1 mol 该物质最多可与2 molNaOH发生反应
11.下列离子方程式正确的是
A.大理石溶于醋酸:![]()
B.铝与氢氧化钠溶液反应:![]()
C.氯气溶于水:![]()
D.向Ca ( HCO3 )2:溶液中滴加过量的 NaOH 溶液:![]()
12 .下列关于有机物的说法中,正确的是
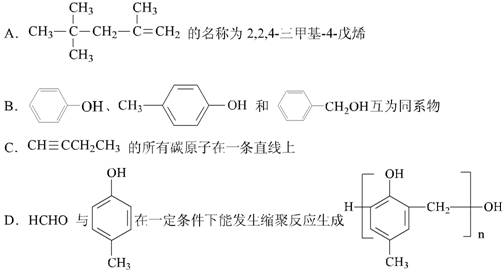
13 .根据下图判断,下列说法正确的是
14.向1 . 00 L0.3mol / L 的NaOH 溶液中缓慢通入8.8gCO2气体,使其完全反应,对反应后的溶液,下列判断正确的是
A.溶质为Na2CO3 B.溶质为NaHCO3
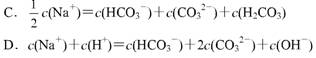
第Ⅱ卷(非选择题共 72 分)
三、(本题包括 1 小题,共 10 分)
15 . ( 10 分)实验室可以通过三条途径来制取氮气:
①加热条件下用NH3还原CuO制得纯净的N2和活性铜粉,反应的化学方程式为: ![]()
② 将空气通过灼热的活性铜粉制得较纯净的N2
③
加热NaNO2(有毒性)与NH4Cl的混合浓溶液制取N2,反应的化学方程式为:![]()
按上述途径制N2可供选择的实验仪器如下图所示,其他必要的仪器如铁架台、铁夹、铁圈、石棉网、酒精灯等未列出。
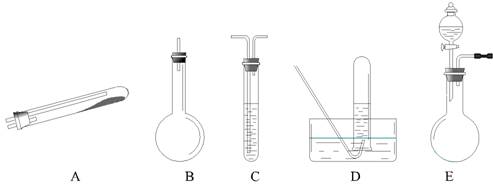
( l )按途径 ① 制取N2时所需的氨气要用浓氨水与生石灰作原料制取,化学方程式为:
![]() ,最好要用上述仪器中
的(填仪器字母,下同)作为氨气发生装置。要制取并收集纯净的N2(允许含少量的水蒸气),还应使用到上述仪器中的
,最好要用上述仪器中
的(填仪器字母,下同)作为氨气发生装置。要制取并收集纯净的N2(允许含少量的水蒸气),还应使用到上述仪器中的
( 2 ) ① 和 ② 两种途径常常被协同使用。这种方法与途径 ③ 相比优点是
( 3 )检查 E 装置气密性的方法是 。利用 E 装置还可以制取的气体有 (写出三种)。
四、(本题包括 2 小题,共 22 分)
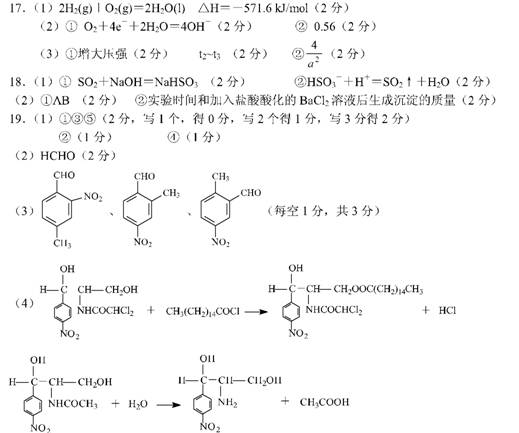
16 . ( 10 分)中学化学中几种常见物质的转化关系如下图所示(部分反应物、生成物及反应条件已略去):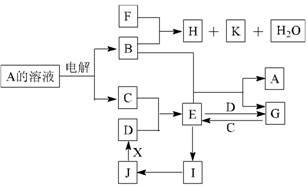
已知:B、C、D为常见单质,其中C为气体,B、D为金属;F为常见的强酸;K常温下为气体,目能使品红溶液褪色;将 E 溶液滴入沸水可制得一种红褐色胶体; J 为红棕色固体。请回答下列问题:
( l ) B 的化学式为 ;
写出 B 与 F 反应的化学方程式
( 2)实验中保存 G 溶液时要加入 目的是
( 3)为实现J一D的变化,若X是非金属单质,则X可能是 (写化学式); 若X是金属单质,请写出 J 一 D 反应的化学方程式
17 . ( 12 分)氢气是一种新型的绿色能源,又是一种重要的化工原料。
(l)氢气燃烧热值高。实验测得,在常温常压下,1gH2完全燃烧生成液态水,放出
142 . 9 kJ 热量。则H2燃烧的热化学方程式为
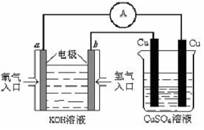 (2)氢氧燃料电池能量转化率高,具有广阔的发展前景。现用氢氧燃料电池进行右图所示实验:
① 氢氧燃料电池中,正极的电极反应式为
(2)氢氧燃料电池能量转化率高,具有广阔的发展前景。现用氢氧燃料电池进行右图所示实验:
① 氢氧燃料电池中,正极的电极反应式为
 ②右图装置中,某一铜电极的质量减轻 3 . 29 ,则 a 极上消耗的O2在标准状况下的体积为
L
( 3 )氢气是合成氨的重要原料,合成氨反应的热化学方程式如下:
②右图装置中,某一铜电极的质量减轻 3 . 29 ,则 a 极上消耗的O2在标准状况下的体积为
L
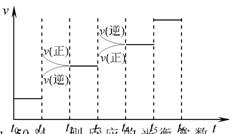
( 3 )氢气是合成氨的重要原料,合成氨反应的热化学方程式如下:![]() ① 当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如右图所示。图中tl 时引起平衡移动的条件可能是
① 当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如右图所示。图中tl 时引起平衡移动的条件可能是
其中表示平衡混合物中NH3的含量最高的一段时间是
②温度为T℃时,将2amolH2和amolN2放入0 . 5L密闭容器中,充分反应后测得N2的转化率为50﹪。则反应的平衡常数为
五、(本题包括 1 小题,共 8 分)
18 . ( 8 分)近年来,江苏省酸雨污染较为严重,防治酸雨成了迫在眉睫的问题。
( l )有人提出了一种利用氯碱工业产品治理含二氧化硫废气的方法,流程如下: ( I )将含SO2的废气通入电解饱和食盐水所得溶液中,得NaHSO3溶液。(Ⅱ)将电解饱和食盐水所得气体反应后制得盐酸。(III)将盐酸加入NaHSO3溶液中得SO2气体回收,生成的NaCl循环利用。
① 写出步骤(I)反应的化学方程式:
② 写出步骤(III)反应的离子方程式:
( 2)还有学者提出利用 Fe 2十、Fe3十等离子的催化作用,常温下将SO2氧化成SO42一而实现SO2的回收利用。某研究性学习小组据此设计了如下方案,在实验室条件下测定转化器中SO2氧化成SO42一的转化率。
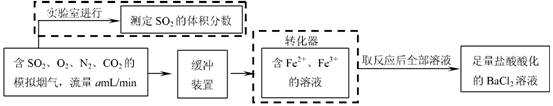
① 该小组采用下图装置在实验室测定模拟烟气中SO2的体积分数,X 溶液可以是 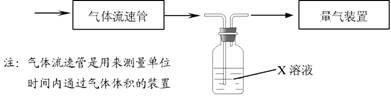
A.碘的淀粉溶液 B . 酸性高锰酸钾溶液C .氢氧化钠溶液 D .氯化钡溶液
② 若上述实验是在标准状况下进行的,欲测定转化器中SO2氧化成SO42一的转化率,已知气体流速,还需测定的数据是
六、(本题包括 1 小题,共 13 分)
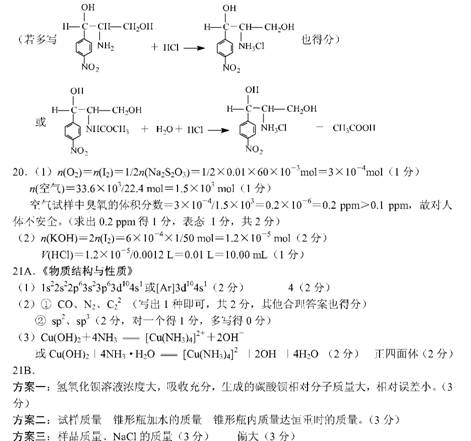
19 . ( 13 分)氯霉素及其衍生物氯霉素棕桐酸酯是广普抑菌抗生素。成氯霉素及其衍生物氯霉素棕桐酸酯的合成路径。
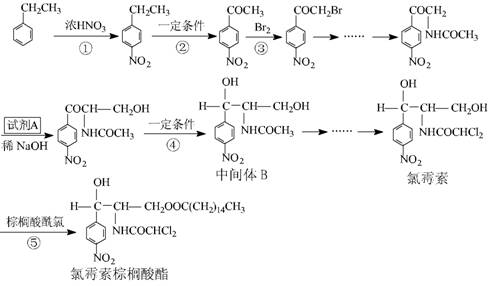
已知: 1 .在稀碱催化下,一些含羰基的化合物能发生如下反应:

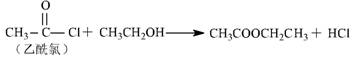
11 .梭酸梭基中轻基被氯原子取代的衍生物叫做酞氯。酞氯可以与醇反应生成醋,例如:
试回答下列问题:
( l )上述转化( ① 一 ⑤ )中,属于取代反应的有 (填序号,下同);属于氧化反应的有 ;属于加成反应的有 ( 2 )试剂 A 的结构简式为


、 、 、
( 4 )写出下列化学方程式
反应⑤
中间体 B 在盐酸作用下发生水解
七、(本题包括 1 小题,共 7 分)
20 . ( 7
分)臭氧可用于净化空气,漂白饮用水,杀菌,处理工业废物和作为漂白剂。但臭氧能刺激粘液膜,空气中臭氧的体积分数超过0.1 PPm ( PPm 表示百力分之一)对人体是不安全的。臭氧能与碘化钾溶液反应:![]() 为测定大气中臭氧的含量,进行如下操作: ①
将标准状况下 33 . 6L的空气试样缓缓通入KI溶液,使之完全反应; ②在所得溶液中用 0 . 01 mol / L 的 Na2S2O3溶液 60 . 00mL 恰好与之完全反应。(反应方程式为:
为测定大气中臭氧的含量,进行如下操作: ①
将标准状况下 33 . 6L的空气试样缓缓通入KI溶液,使之完全反应; ②在所得溶液中用 0 . 01 mol / L 的 Na2S2O3溶液 60 . 00mL 恰好与之完全反应。(反应方程式为:![]() 设反应过程中溶液的体积变化忽略不 计)
设反应过程中溶液的体积变化忽略不 计)
( l )试通过计算说明该空气试样中臭氧的体积分数对人体是否安全?
( 2 )取步骤 ① 所得溶液的1 / 50 ,欲将其中所含 KOH 完全中和,需 0 . 0012 mol / L 的盐酸体积是多少毫升?
原题:超细硅酸铝具有极好的悬浮性和纯白外观,与颜料配合能明显地改进涂料的白度。其样品化学式可表示为![]() 企业标准规定超细硅酸铝中含水量7%一10%为优良级。某化学兴趣小组为测定该样品的组成,按如下步骤处理:步骤一:准确称取 9 . 936g 超细硅酸铝样品,充分加热至不再分解为止,冷却、称量,得固体9.216g 。步骤二:另准确称取 9 . 936g 超细硅酸铝样品,加足量 4 mol / L 盐酸 150 mL ,充分反应后,过滤,洗涤,烘干得SiO2固体 8 . 400g
企业标准规定超细硅酸铝中含水量7%一10%为优良级。某化学兴趣小组为测定该样品的组成,按如下步骤处理:步骤一:准确称取 9 . 936g 超细硅酸铝样品,充分加热至不再分解为止,冷却、称量,得固体9.216g 。步骤二:另准确称取 9 . 936g 超细硅酸铝样品,加足量 4 mol / L 盐酸 150 mL ,充分反应后,过滤,洗涤,烘干得SiO2固体 8 . 400g
( l )计算该超细硅酸铝样品是否为优良级。
( 2 )求该样品的化学式。
八、(本题分A、B两题,考生只要选择其中一题作答。若两题都作答,则一律以A题得分计入总分。本题共12 分。)
 21A .《 物质结构与性质
》( 12 分)
21A .《 物质结构与性质
》( 12 分)
铜合金是人类使用最早的金属材料。铜在化合物中的常见化合价有+ l 、 + 2 等,故能形成多种铜的化合物。
( l )基态 Cu 原子的电子排布式是 ;
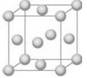
铜晶体晶胞如图所示,该晶胞实际拥有 个铜原子;
( 2 ) ①
某+ l 价铜的配离子为![]() ,与配体互为等电子体的一种微粒是
,与配体互为等电子体的一种微粒是
(写化学式)。
②许多+l价铜的配合物溶液能吸收CO和烯烃(如C2H4、CH3CH= CH 2等), CH3CH= CH 2分子中c 子采取的杂化方式有
( 3 )在硫酸铜溶液中逐滴滴加氨水至过量,先出现蓝色沉淀,最后溶解形成深蓝色的溶液。写出此蓝色沉淀溶解的离子方程式: ;
根据价层电子对互斥模型,预测SO42一的空间构型为
21B . ( (实验化学) ) ( 12 分)氢氧化钠固体常因吸收空气中的二氧化碳而变质。某研究性学习小组为探究氢氧化钠固体样品中的碳酸钠含量,设计了多种实验方案,请结合以下方案回答有关问题:
方案一:称取一定量的氢氧化钠样品mlg ,加水溶解后,逐滴加入沉淀剂至不再产生沉淀为止。将沉淀过滤、洗涤、烘干、称量,质量为 m : g 。沉淀剂使用氢氧化钡溶液而不用氢氧化钙溶液,结果将具有更高的精确度,原因是
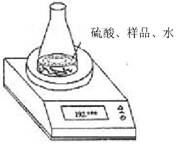 方案二:利用右图装置测定氢氧化钠样品中 Na2CO3的含量。计算Na2CO3质量分数时,必需的数据是
方案二:利用右图装置测定氢氧化钠样品中 Na2CO3的含量。计算Na2CO3质量分数时,必需的数据是
方案三:操作流程如下:
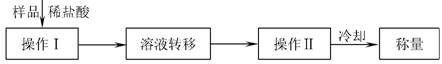
需直接测定的数据是 ;在转移溶液时,如溶液转移不完全,则Na2CO3质量分数的测定结果 (填“偏大”、“偏小”或“不变”)。
南京市 2007 一 2008 学年度第一学期期末调研测试卷参考答案及评分标准高三化学
1~5、D、C、A、B、C 6~10、A、D、C、BC、B 11~14、A、D、C、D
15 . ( l ) E A 、D或A、C、D
( 2 ) Cu 和 CuO 可以循环使用,避免了使用有毒物质。(其他合理答案均可得分)
( 3 )用止水夹夹紧 E 中乳胶管,向分液漏斗中加入适量水,打开活塞,若最终液面保持恒定,则证明该装置不漏气(其他合理答案也给分)。 H2、O2、CO2、C12、SO2、NO2、 NO等(写出任意 3 种得 2 分,写出 2 种得 l 分,写出 l 种得 0 分)(以上每空 2 分,共 10 分)