第4课时 化学实验方案的设计与评价(A卷)
考测点导航
1.化学实验方案设计的基本要求
化学实验方案的设计基本要求是方法简便、原料或药品易得、现象明显、操作易行、环保防污。
2.化学实验方案设计的一般方法
(1)明确目的原理
首先必须认真审题(如要求采用最简单或最佳的方案,制取纯净的某物质等),明确实验的目的要求。弄清题目有哪些新的信息,综合已学过的知识,通过类比、迁移、分析,从而明确实验原理。
(2)选择仪器药品
根据实验的目的和原理,以及反应物和生成物的性质、反应条件,如反应物和生成物的状态、能否腐蚀仪器和橡皮,反应是否加热及温度是否控制在一定范围,给出的药品、仪器或装置是否足够,需要补充还是筛选,仪器药品的规格等。从而选择合理的化学仪器和药品。
(3)设计装置步骤
根据上述实验目的和原理,以及所选用的实验仪器和药品,设计出合理的实验操作步骤、实验装置。学生应具备识别和绘制典型的实验装置图的能力,实验步骤应完整而又简明。
(4)记录现象数据
根据观察,全面准确地记录实验过程中的现象和数据。
(5)分析得出结论
根据实验观察的现象和记录的数据,通过分析、计算、图表、推理等处理,得出正确的结论。
典型题点击
1.(2000年上海高考题)某课外活动小组加热炭粉(过量)和氧化铜的混合物,再用下图装置,对获得的铜粉(含炭)样品进行实验。图中铁架台等装置已略去。请你帮助他们完成下列实验报告。
| 实验过程 | 实验现象 | 有关化学方程式 |
|
|
| |
| 打开A的活塞,慢慢滴加溶液。 | ||
| 对C进行加热。当C中药品充分反应后。关闭A的活塞。停止加热: | ||
|
|
|
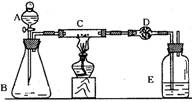
(1)实验目的: 。
(2)实验用品:仪器:天平、分液漏斗、锥形瓶、硬质玻璃管、干燥管、酒精灯、洗气瓶等,药品:红褐色铜粉(含炭)样品、过氧化氢溶液、二氧化锰、碱石灰、浓硫酸等。
(3)实验内容(见表1)。
表1 实验步骤、现象及化学方程式:
(4)计算:样品中铜的质量分数=_________。(用含W、m1、m2的代数式表示。)
(5)问题和讨论:
实验完成后,老师评议说:按上述实验设计,即使C中反应完全、D中吸收完全,也不会得出正确的结果。经讨论,有学生提出在B与C之间加入一个装置,再次实验后,得到了较正确的结果。那么,原来实验所测得的铜的质量分数偏小的原因可能是__________。在B与C之间加入的装置可以是_____________,其中盛放的药品是____________。
(该题是对一个相对完整的实验方案加以分析、推理、评价的综合性实验简答题,意在考查学生的观察能力、实验能力和思维能力。解答此题的关键在实验报告的仪器和药品一项,由此可确定反应的装置和反应原理。)
2.(2003年南京市高三化学模拟题)以浓硫酸、浓硝酸、粗铜、水和空气为原料可制得硫酸铜(CuSO4·5H2O)。制取硫酸铜晶体的过程如下图所示。
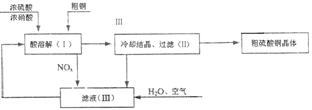
(1)写出制取硫酸铜的总反应方程式 。
(2)在上述生产过程中,被循环使用的物是 。
(3)请你选用下列适宜的装置来模拟上述生产过程。将它们的编号填入方框。

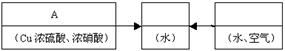 |
(本题考查了学生对几种常见物质性质的掌握情况及分析评价能力。答题时由题给条件确定反应原理,看懂流程图,明确各步的实验目的,通过分析、比较确定方案。)
新活题网站
1.某学生利用厨房中的用品进行小实验研究,现有:鸡蛋壳、食醋、纯净水、食盐、干电池、石墨电极及导线,你认为他不能完成的家庭小实验有( )
A.除去鸡蛋白溶液中的少量食盐 B.自制家用含次氯酸钠溶液的消毒剂
C.检验碘盐中是否加有碘酸钾 D.除去热水瓶胆内的水垢
(本题是化学联系生活实际的问题,考查学生对所提供用品的组成、性质熟悉的情况以及灵活运用能力。答题时注意完成这些实验的条件。)
2.请设计简单的方案证明KMnO4溶液的颜色是由于MnO4-的存在而引起的?(用多种方法)
(此题考查学生对物质的检验实验方案设计的能力。
答题时利用物质的性质,通过对比解决问题。)
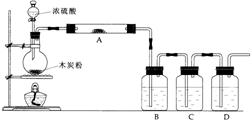 3.根据下图回答问题:
3.根据下图回答问题:
(1)上述装置中,在反应前用手掌紧贴烧瓶外壁检查装置的气密性,如观察不到明显的现象,还可以用什么简单的方法证明该装置不漏气。
答: ;
(2)写出浓硫酸和木炭粉在加热条件下发生反应的化学方程式: ;
(3)如果用图中的装置检验上述反应的全部产物,写出下面标号所表示的仪器中应加入的试剂的名称及其作用:
A中加入的试剂是 ,作用是 。
B中加入的试剂是 ,作用是 。
C中加入的试剂是 ,作用是除尽 气体。
D中加入的试剂是 ,作用是 。
(4)实验时,C中应观察到的现象是
。
(该题考查学生对较复杂装置气密性的检查情况,浓硫酸与木炭粉反应产物检验方案的设计与评价能力。答题时要注意三种产物检验的先后顺序,排除可能产生的干扰。)
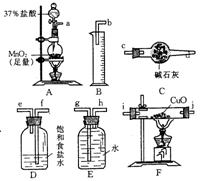 4.实验室可用2Cl2+2CuO=2CuCl2+O2的反应来测定铜的近似相对原子质量。试回答:
4.实验室可用2Cl2+2CuO=2CuCl2+O2的反应来测定铜的近似相对原子质量。试回答:
(1)为测定反应物CuO的质量[记作m(CuO)g]和生成物O2的体积(标准状况下)[记作V(O2)mL],请用图所列仪器设计一个简单的实验方案:
①按气体流向从左到右,用乳胶管(图中未画出)连接上述仪器,组合成一套实验装置,正确的连接顺序是 (用导管口序号填写),装置C的作用是 。实验完毕时在F的反应管中观察到的现象是 。
②计算Cu的相对原子质量的表达式是 。(已知氧的相对原子质量为16)
(2)下列情况中会使测定结果偏大的是 。
A.CuO未全部转化为CuCl2 B.CuO受潮
C.CuO中混有Cu D.未使用C装置 E.未使用D装置
(3)如果仍采用上述仪器设计另外的实验方案,还可以测定其他物理量来求出Cu的相对原子质量,这些物理量是 。
A.m(CuO)、m(CuCl2) B.m(Cl2)、V(O2)
C.m(CuCl2)、V(O2) D.V(HCl)、V(O2)
(本题考查了气体的制备原理、净化方法、数据的采集和处理,利用常用的化学仪器作定量实验等设计实验方案的能力。答题时依据物质制备的一般思路,冷静地审题、联系所学过的实验知识和实验技能,进行知识类比、迁移、重组,全面而细致的思考可回答问题。)
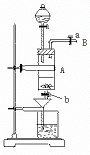 5.三氯化铁是中学化学实验室中必不可少的重要试剂。某同学利用废铁屑(含少量铜等不与盐酸反应的杂质)来制备FeCl3·6H2O,该同学设计的实验装置如图3所示,A中放有废铁屑,烧杯中盛有过量的稀硝酸,实验时打开a,关闭b,从分液漏斗内向A中滴加过量盐酸,此时溶液呈浅绿色,再打开b进行过滤,过滤结束后,取烧杯内溶液倒入蒸发皿加热,蒸发掉部分水并使多余HNO3分解,再降温结晶得FeCl3·6H2O晶体。填写下列空白:
5.三氯化铁是中学化学实验室中必不可少的重要试剂。某同学利用废铁屑(含少量铜等不与盐酸反应的杂质)来制备FeCl3·6H2O,该同学设计的实验装置如图3所示,A中放有废铁屑,烧杯中盛有过量的稀硝酸,实验时打开a,关闭b,从分液漏斗内向A中滴加过量盐酸,此时溶液呈浅绿色,再打开b进行过滤,过滤结束后,取烧杯内溶液倒入蒸发皿加热,蒸发掉部分水并使多余HNO3分解,再降温结晶得FeCl3·6H2O晶体。填写下列空白:
(1)从B导管收集产生的气体可采用的方法是 。
(2)滴加盐酸时,发现反应速率较之盐酸与纯铁粉反应要快,其原因是 。
(3)烧杯内放过量稀HNO3的原因是 ,离子方程式是 。
(4)整个实验过程中,弹簧夹a都必须打开,除了为排出产生的气体外,另一个目的是 。
(5)用降温结晶法制得FeCl3·6H2O,而不用直接蒸干的方法来制得晶体的理由是
。
(该题意在考查学生对化学实验装置的理解,运用学过的知识对陌生的实验装置予以解释的能力。答题时要仔细观察装置,领会仪器的所起的作用。)
答案分析:
典型题点击
1.(1)测定铜粉样品中铜的质量分数
![]() (3)
(3)
| B、E中有气泡产生
|
|
| C中的红褐色粉末变成黑色 |
C+O2 CO2 |
(4)![]()
(5)偏小:水蒸汽通过C被D中碱石灰吸收; 洗气瓶 浓硫酸 (或干燥管 碱石灰)
讲析:从H2O2和MnO2可推知两者可制氧气,氧气可以氧化样品中混有的炭粉;干燥管中药品用于吸收产生的CO2,因此盛放的是碱石灰。第(5)小题出现了实验结果负误差,所以一定是D多吸收了什么物质,由此可以结合化学方程式找到水的存在,进而得到这一问题的答案。
2.(1)2Cu+O2+2H2SO4=2CuSO4+2H2O。 (2)HNO3 (3)B、A。
新活题网站
1.C 讲析:蛋壳内膜作为半透膜,鸡蛋白溶液为胶体,通过渗析可除去其中的少量食盐;电解食盐水可自制家用含次氯酸钠溶液的消毒剂;检验碘盐中是否加有碘酸钾,缺少还原剂将IO3-还原;水垢为碳酸钙和氢氧化镁的混合物,用醋酸除去。答案为C。
2.方法一:对照实验:用KCl溶液和KMnO4溶液进行比较,得出结论。
方法二:利用 MnO4- 的强氧化性。向溶液中加入还原性的物质(Na2SO3、浓HCl、FeCl2、H2O2等)
3.(1)反应前点燃酒精灯,加热烧瓶一小会儿。在瓶B、C、D中出现气泡,熄灭酒精灯,瓶B、C、D中导管液面上升,证明该装置不漏气。
(2)2H2SO4(浓)+C![]() CO2↑+2SO2↑+2H2O
CO2↑+2SO2↑+2H2O
(3)无水硫酸铜 检验 H2O
品红溶液 检验 SO2
足量酸性 KMnO4 溶液 SO2
澄清石灰水 检验 CO2
(4) 导管有气泡冒出;溶液紫色逐渐变浅;瓶底有少量黑色固体生成。
4.(1)①a→f ,e→i, j→c, d→h, g→b
除去多余的Cl2 黑色粉末变为棕色
②![]() (2)ABCE (3)AC
(2)ABCE (3)AC
讲析:制得的Cl2中含有HCl、H2O,因HCl的存在对Cl2和CuO的反应产生影响,必须除去。H2O的存在对此反应无影响,要想除去得通过碱石灰,碱石灰又能吸收Cl2,故H2O不必除去。由B和E组成量气装置(应从短管口进气),在气体通入之前,需除去多余的Cl2。则装置连接顺序:制取Cl2用A,除去其中的HCl用D,发生Cl2和CuO的反应用F,除去多余的Cl2并吸水用C,量气装置由B和E组成。
5.(1)用排水取气法或向下排空气取气法
(2)因废铁屑中含少量Cu等不与HCl反应的杂质,形成Fe-Cu原电池使反应速率加快
(3)稀HNO3有强氧化性,为保证使Fe2+全部氧化成Fe3+
3Fe2++4H++NO![]() ====3Fe3++NO↑+2H2O
====3Fe3++NO↑+2H2O
(4)与大气相通,使分液漏斗中的酸可滴入A中
(5)因为FeCl3是强酸弱碱盐水解:FeCl3+3H2O![]() Fe(OH)3+3HCl,加热蒸干时使HCl挥发造成水解平衡右移,因此得不到FeCl3·6H2O
Fe(OH)3+3HCl,加热蒸干时使HCl挥发造成水解平衡右移,因此得不到FeCl3·6H2O
 在C中加入样品标本W克,D中装入药品后并称量为m1g。连接好仪器后,检查气密性
在C中加入样品标本W克,D中装入药品后并称量为m1g。连接好仪器后,检查气密性