必修(2)过关测试题
一、选择题(每小题3分,共54分)
1、据报道,某些花岗岩会产生氡(22286Rn),这是一种放射性很强的原子,会对人体产生伤害,因此,家庭装修时应尽量避免使用天然产的花岗岩材料。已知氡是一种稀有气体元素,下列叙述正确的是( )
A.该原子与同周期ⅠA、ⅡA族阳离子具有相同的核外电子层结构
B.该原子最外层有8个电子
C.该原子中子数是86
D.1mol气体氡的质量大约是444g
2、(CN)2、(SCN)2、(OCN)2称“类卤素”,与卤素单质的性质相似,而其阴离子性质也相似,如:2Fe+3(SCN)2=2Fe(SCN)3,2Fe+3Cl2=2FeCl3。以此判断下列方程式中错误的是( )
A、(CN)2+H2O = HCN+HCNO B、(SCN)2+2Cu △ 2CuSCN
C、(OCN)2+2NaOH = NaOCN+NaOCNO+H2O D、H2+(SCN)2 △ 2HSCN
3、下列关于化学键的说法正确的( )。
A、只存在于分子之间 B、只存在于离子之间
C、相邻原子间强烈的相互作用 D、相邻分子间的相互作用
4、某元素原子的原子核外有三个电子层,最外层有4个电子,该原子核内的质子数为( )
A、14 B、 15 C、16 D、17
5、下列微粒中半径最小的( )
A、 Na+ B、Al C、K+ D、S2-
6、下列物质中,存在非极性键的化合物的是( )
A、NaOH B、CH4 C、I2 D、Na2O2
7、某元素最高价氧化物对应水化物的化学式H3XO4是,这种元素的气态氢化物的化学式是( )
A、H2X B、HX C、XH3 D、XH4
8、下列关于4220Ca2+的叙述中,正确的是( )
A、质子数为22 B、电子数为20 C、中子数为18 D、质量数为42
9、某元素B的核电荷数为Z。已知Bn-与Am+的核外具有相同的电子层结构,如果A元素的原子序数用Z、n、m来表示,应表示为( )
A、Z+m-n B、Z-n+m C、Z-n-m D、Z+n+m
10、实验室中欲加快制取氢气的速率,应采取的措施是 ( )
A.纯锌与稀硫酸反应 B.纯锌与浓硫酸反应
C.含铜、铅等杂质的粗锌与稀硫酸反应 D.粗锌与稀硝酸反应
11、下列化合物中阳离子半径与阴离子半径比值最小的是( )。
A、NaBr
B、MgI2 C、CaI2 D、KBr
12.继科学家发现C3O2是金星大气的成分后,2004年,美国科学家通过“勇气”号太空探测出火星大气中含有一种称为硫化碳(化学式为COS)的物质。已知硫化碳与二氧化碳的结构相似,但在氧气中会燃烧。下列说法中不正确的是( )
A. C3O2与CO一样可以在氧气中燃烧生成CO2
B. C3O2 、CO 与CO2都是碳的氧化物,它们互为同素异形体
C.硫化碳在氧气中完全燃烧的产物是CO2和SO2
D.因为COS有明显的还原性,所以火星大气中不可能有氧气
13、在一定条件下,反应N2+3H2![]() 2NH3,在2L密闭容器中进行,5min内氨的质量增加了1.7g,则反应速率为 ( )
2NH3,在2L密闭容器中进行,5min内氨的质量增加了1.7g,则反应速率为 ( )
A、V(H2)=0.03mol/(L·min) B、V(N2)=0.005mol/(L·min)
C、V(NH3)=0.17mol/(L·min) D、V(NH3)=0.02mol/(L·min)
14、 人造地球卫星用到的一种高能电池——银锌蓄电池,其电池的电极反应式为Zn + 2OH- - 2e- = ZnO + H2↑,Ag2O + H2O + 2e- = 2Ag+ 2OH-。据此判断氧化银是( )
A、负极,并被氧化 B、正极,并被还原
C、负极,并被还原 D、正极,并被氧化
15、下列离子方程式中正确的是( )
A、铁跟稀硫酸反应:2Fe+6H+ = 2Fe3++3H2↑
B、碳酸氢钙溶液跟盐酸反应: Ca(HCO3)2+2H+ = Ca2++2H2O+2CO2↑
C、醋酸跟氢氧化钾溶液反应: CH3COOH+OH- = CH3COO-+H2O
D、碳酸镁跟稀硫酸反应: CO32-+2H+ = Mg2++H2O+CO2↑
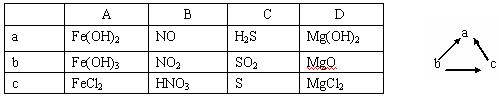
16.下列各组物质中,不能按右图所示关系相互转化的是("→"表示一步完成)( )
17.某烃有两种或两种以上的同分异构体,其同分异构体中的某一种的一氯代物只有一种,
则这种烃可能是( )
①分子中具有7个碳原子的芳香烃 ②分子中具有4个碳原子的烷烃 ③分子中具有12个氢原子的烷烃 ④分子中具有6个碳原子的烷烃 ⑤分子中具有8个碳原子的烷烃
A. ①②③ B. ③⑤ C. ③④⑤ D. ②③④⑤
18. 有人认为CH2==CH2与Br2的加成反应,实质是Br2先断裂为Br+和Br-,然后Br+首先与CH2==CH2一端碳原子结合,第二步才是Br-与另一端碳原子结合。已知I2和I-无此类反应。如果让CH2==CH2与Br2在盛有NaCl 和NaI的水溶液中反应,则得到的有机物不可能是()
A.BrCH2CH2Br B. ClCH2CH2I C. BrCH2CH2I D. BrCH2CH2Cl
二、填空题(本大题3个小题,共38分)
19.Ⅰ.(8分)不同元素的原子在分子内吸引电子的能力大小可以用一定数值x来表示,若x值越大,其原子吸引电子的能力越强,在所形成的分子中成为带负电荷的一方。下表是某些短周期元素的x值:
| 元素符号 | Li | Be | B | C | O | F | Na | Al | Si | p | S | Cl |
| x值 | 0.98 | 1.57 | 2.04. | 2.55 | 3.44 | 3.98 | 0.93 | 1.61 | 1.90 | 2.19 | 2.58 | 3.16 |
(1)通过分析值的变化规律,确定、Mg的x值范围:
>x(Mg)> , >x(N)> 。
(2)推测x值与原子半径的大小关系是 。根据短周期元素x值的变化特点,体现了元素性质的 变化规律。
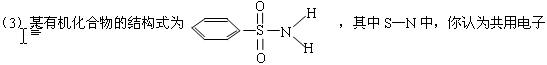
对偏向谁?(写原子名称) 。
(4)经验规律告诉我们:当成键的两个原子相应元素的x差值(Δx)即Δx>1.7时,一般
为离子键,Δx<1.7时,一般为共价键,试推断:AlBr3中化学键的类型是 。
(5)预测元素周期表中x值最小的元素的位置(放射性元素除外): 。
Ⅱ.(8分)X、Y、Z为三种不同短周期非金属元素的单质。在一定条件下发生如下反应:
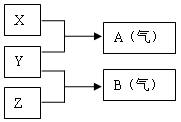
请针对以下两种不同的情况回答:
(1)若常温下X、Y、Z均为气体,且A和B在化合生成固体C时有白烟产生,则:
①Y的化学式是 ;
②生成固体C的化学方程式是 。
(2)若常温下Y为固体,X、Z为气体,A在空气中充分燃烧可生成B,则:
①B的化学式为 ;
②向苛性钠溶液中通入过量的A所发生反应的离子方程式为 ;
③将B与(1)中某单质的水溶液充分反应可生成两种强酸,该反应的化学方程式为
。
20.(11分)阅读下列文字,填写文中带圈的数字后面的空白:
某同学发现,纯度、质量、表面积都相同的两铝片与c(H+)浓度相同的盐酸和硫酸在同温同压下反应时产生氢气的速率差别很大,铝与盐酸反应速率更快。他决定对其原因进行探究。
(一)该同学认为:由于预先控制了反应的其他条件,那么,两次实验时反应的速率不一样的原因,只有以下五种可能:
原因Ⅰ:Cl-对反应具有促进作用,而SO42-对反应没有影响;
原因Ⅱ:① ;
原因Ⅲ:Cl-对反应具有促进作用,而SO42-对反应具有阻碍作用;
原因Ⅳ:Cl-、SO42-均对反应具有促进作用,但Cl-影响更大;
原因Ⅴ:②
(二)该同学取了两片等质量、外形和组成相同、表面经过砂纸充分打磨的铝片,分别放入到盛有同体积、c(H+)相同的稀硫酸和盐酸的试管(两试管的规格相同)中:
1.在盛有硫酸的试管中加入少量NaCl或KCl固体,观察反应速率是否变化;
2.在盛有盐酸的试管中加入少量Na2SO4或K2SO4固体,观察反应速率是否变化。
若观察到实验1中③ ,实验2中④ ,则说明原因Ⅲ是正确的。依次类推。该同学通过分析实验现象,得出了结论:Cl-对反应具有加速作用。
(三)为了使实验“定量化”、使结果更精确,可以对实验进行如下改进:
1.配制c(H+)相同的稀盐酸和稀硫酸:现有浓度为1mol·L-1的盐酸和密度为1.225g·cm-3、质量分数为20%的硫酸,若要准确量取该硫酸20.00mL,需要用⑤ (填仪器名称);将量取的硫酸配制成c(H+)=1mol·L-1的溶液,可得溶液的体积为⑥ 。
配制溶液时还需要用到的玻璃仪器有⑦ 、烧杯、胶头滴管和量筒等。
2.比较反应速率:反应时间可以用秒表测定。如果要对上述实验中的反应速率进行比较,可以通过测定哪些物理量来确定?要求回答一种即可。⑧ 。
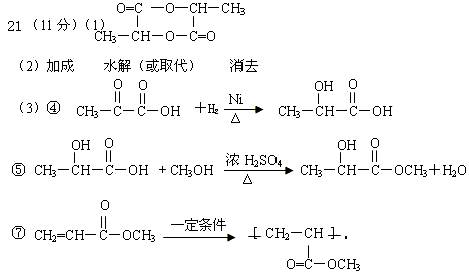
21.(11分) 已知R表示烃基,R/表示烃基或氢原子,
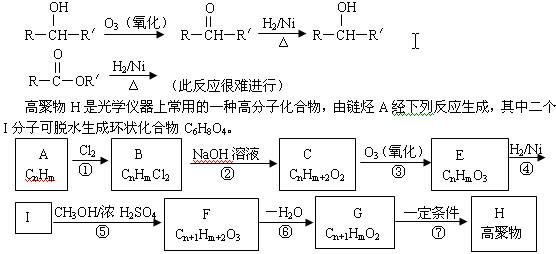
请回答下列问题:
(1)C6H8O4的结构简式是 。
(2)说明下列反应的类型:①是 反应;②是 反应;⑥是 反应。
(3)分别写出反应④、⑤和⑦的化学方程式(有机物用结构简式):
④ ;
⑤ ;
⑦ 。
三、计算题(8分)
22、某元素R的核外电子数等于核内中子数,2.8克该元素单质与氧气完全反应,可得到6克化合物RO2。
(1)该元素的原子的质量数为多少,是什么元素?
(2)如果把2.8克该元素单质投入到足量的氢氧化钠溶液中,生成的气体在标准状况下的体积是多少?
参考答案
一、选择题(每小题3分,共45分)
1、B2、B3、C4、A5、A6、D7、C8、D9、D10、C11、B12、B13、B14、B15、C16、C17、B18、B
二、填空题(本大题3个小题,共38分)
19.Ⅰ.(8分)(1)1.61>x(Mg)>0.93 2.55>x(N)>3.44
(2)x值越大,相应原子的原子半径越小 周期性 (3)氮
(4)共价键 (5)铯(或Cs)
Ⅱ.(8分)①H2 ②NH3+HCl=NH4Cl
(2)①SO2 ②H2S+OH-=HS-+H2O ③ SO2+Cl2+2H2O=H2SO4+2HCl
20.(11分)①Cl-对反应没有影响,而SO42-对反应具有阻碍作用(1分);②Cl-、SO42-均对反应具有阻碍作用,但Cl-影响更小(或SO42-影响更大)(1分)。③反应速率加快(1分) ;④反应速率减慢(1分)⑤酸式滴定管(1分,只回答“滴定管”不得分)⑥100mL(2分)⑦100mL容量瓶、玻璃棒(2分,每项1分,漏掉100mL扣1分)⑧消耗完相同质量的铝片需要的时间(或相同的时间内消耗铝片的质量)(2分)。或相同的时间里收集到的氢气的体积(或者收集相同体积的氢气所消耗的时间)(其他答案合理同样给分)
三、计算题(7分)
22、(1)28;Si
(2)Si+2NaOH+H2O=Na2SiO3+2H2↑;4.48L