专题(四) 元素周期表
学习目标:1、掌握元素周期律的实质,了解周期表的结构
2、理解“位置、结构、性质”之间的辩证关系
3、掌握同元素周期律解决实际问题的思路与方法
4、关注原子结构、周期律的新信息,加强与其他知识块的整合
典型例题:
例1:同周期的X、Y、Z三种元素,已知其氢化物分别为XH3、H2Y、HZ,则下列判断正确的是
A. 原子半径 Z > Y > X
B.Z的非金属性最强
C.氢化物还原性XH3 > H2Y > HZ,稳定性XH3 > H2Y > HZ
D.最高氧化物对应水化物H3XO4酸性最强
例2:等电子原理:原子数相同、电子总数相同的分子互称为等电子体。等电子体的结构相似、物理性质相近。
(1)根据上述原理,仅由第2周期元素组成的共价分子中,互为等电子体的是: 和 ;
和 。
(2)此后,等电子原理又有所发展。例如,由短周期元素组成的微粒,只要其原子数相同,各原子最外层电子数之和相同,也可互称为等电子体,它们也具有相似的结构特征。在短周期元素组成的物质中,与NO2–互为等电子体的分子有: 、 。
课堂练习:
1. 有人建议将氢元素排在元素周期表的VIIA族。下列事实能支持这一观点的是 ( )
①H原子得到一个电子实现最外电子层稳定结构;②氢分子的结构式为H─H;③与碱金属元素形成离子化合物M+[:H]–;④分子中原子间的化学键都属于非极性键
A.只有①②③ B.只有①③④ C.只有②③④ D.有①②③④
2. X和Y均为短周期元素,已知aX n -比bY m +多两个电子层,则下列说法正确的是 ( )
A.b = 1 B.X只能位于第3周期
C.a + n - ( b – m ) = 10或16 D.Y不可能位于第2周期
3.已知A、B、C、D、E是核电荷数依次增大的五种短周期元素,原子半径按D、E、B、C、A的顺序依次减小,B和E同主族。下列推断不正确的是 ( )
A. A、B、E一定在不同周期
B. C的最高价氧化物的水化物可能显碱性
C. A、D可能在同一主族
D.C和D的单质可能化合形成离子化合物
4.下列说法中不正确的是 ( )
①质子数相同的粒子一定属于同种元素;②电子数相同的粒子不一定是同一种元素;③一种元素只能有一种质量数;④某种元素的相对原子质量取整数,就是其质量数;⑤质子数相同,电子数也相同的粒子,不可能是一种分子和一种离子;⑥同位素的性质几乎完全相同
A.①③④⑥ B.①②④⑤ C.②③⑤⑥ D.②⑤
5.已知a An +, b B( n + 1 )+, c Cn–, d D( n + 1 )–是具有相同的电子层结构的短周期元素形成的简单原 子,下列叙述正确的是 ( )
A.原子半径:C > D > A > B B.原子序数:b > a > c > d
C.离子半径:C > D > A > B D.单质还原性:A > B > C > D
6. A、B、C、D是20号以内的四种元素,其原子序数依次增大。C和D可形成化合物X,A和B可形成化合物Y,将少量X和过量Y一起放入水中,可放出一种无色无味的气体,同时得到一种无色澄清的溶液。向此溶液中滴加过量X的水溶液时,可生成一种白色胶状沉淀物Z(Z与Y的相对原子质量相等)。过滤后得到一种无色澄清溶液,其中含G,G的焰色呈黄色,向G的水溶液中加入酸化的硝酸银溶液时,能生成一种白色沉淀。根据以上推断:
(1)A是 ,B是 ,C是 ,D是 。
(2)X的分子式是 ,Y的化学式是 。
(3)4 mol X与6 mol Y在水溶液中发生反应的化学方程式是 。
(4)生成白色胶状沉淀物Z的离子方程式是: 。
7.A、B、C、D、E五种元素,已知:
(a)A 原子最外层电子数是次外层电子数的两倍,B的阴离子与C的阳离子跟氖原子的电子层结构相同,E 原子M层上的电子比K层多5个。
(b)常温下B2是气体,它对氢气的密度为16。
(c)C单质在B2燃烧,生成淡黄色固体。F与AB2反应可生成B2。
(d)D的单质在B2中燃烧,发出蓝紫色火焰,生成有刺激性气味的气体DB2。
(1)A是 ,B是 ,C是 , D是 ,
E是 。(写元素符号)
(2)E的原子结构示意图: ;C的离子结构示意图: 。
(3)F与AB2反应的方程式: 。
8.已知A、B、C、D均为短周期元素,它们的原子序数依次递增。 A是最外层为一个电子的非金属元素,C 原子的最外层电子数是次外层的3倍; C和D可形成两种固态化合物,其中一种为淡黄色固体;B和C可形成多种气态化合物。A、B、C三种元素可以形成离子晶体,该晶体中各元素原子的物质的量之比为A:B:C=4:2:3。请回答下列问题:
(1)写出B的原子结构示意图 ,写出C和D形成的淡黄色固体化合物的电子式 。
(2)元素原子的物质的量之比为A:B:C=4:2:3 的晶体名称为 , 其水溶液显 性,其反应的离子方程式为 。
(3)请写出A2C和BA3分子中电子数相同,且仍由A、B、C元素中任意两种元素组成的微粒的符号(举两例) 、 。
(4)写出由B、C元素组成且元素原子质量比为B:C=7:12的化合物的化学式 。
课后练习:
1.下列叙述正确的是 ( )
A.同周期元素中,ⅦA族元素的原子半径最大
B.现已发现的零族元素的单质在常温常压下均为气体
C.ⅥA族元素的原子,其半径越大,越容易得到电子
D.所有的主族元素的简单离子的化合价与其族序数相等
2.元素周期表对工农业生产具有一定的指导作用,下列说法中不正确的是 ( )
A. 通常农药中所含的元素位于周期表右上角
B. 半导体材料在金属元素和非金属元素分界线附近
C. 在过渡元素中可以寻找新型催化剂材料
D.在IA族元素中寻找新型耐高温耐腐蚀的材料
3.某主族元素的离子X2+有6个电子层,最外层有2个电子,当把XO2溶于浓盐酸时,有黄绿色气体产生,则下列说法正确的是 ( )
A.X2+具有强还原性 B.XCl2溶液呈中性
C.XO2具有强氧化性 D.该元素是ⅡA族
4.有位于20号元素前, 原子叙述依次递增的A、B、C、D、E五种元素。A、C元素的电子层数相同;A、E两元素的最外层和次外层电子数相同; A和C可形成化合物AC,D和E可形成ED2;B元素的原子最外层即M层有3个电子。
(1)试写出这五种元素的名称及符号:A 、 B 、
C 、D 、E 。
(2)写出下列反应的化学反应式:
①A+C→AC
②D+E→ED2
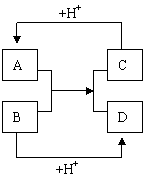 |
5.A、B、C、D分别是由两种短周期元素组成
的常见微粒(或粒子),这四种微粒中均含有相
同数目的电子,且共含有三种元素。其中A中
含有5个原子核,它们之间有如图的反应关系:
(1)A、D的电子式分别为: A ,
B 。
(2)B、C、D三种微粒结合质子能力x > y > z,(x、y、z
分别代表B、C、D中的某一种微粒), 则x、y、z分别
代表的微粒符号为x , y , z 。
专题(四)答案例题:1B 例题2 :(1)N2, CO; CO2, N2O (2)O3, SO2
课堂练习:
| 1A | 2C | 3A | 4A | 5B |
6. (1) O, Na, Al, Cl (2) AlCl3, Na2O2
(3)4AlCl3 + 6Na2O2 + 6H2O = 4Al(OH)3↓+ 12NaCl + 3O2 ↑
(4)Al3+ + 3AlO2– + 6H2O = 4Al(OH)3 ↓
7. (1) C; O; Na; S; Cl
(2) 略
(3)2Na2O2 + 2CO2 = 2Na2CO3 + O2
 | |||
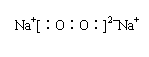 | |||
8. (1) N
![]() (2) 硝酸铵;酸;NH4++H2O NH3·H2O
+ H+
(2) 硝酸铵;酸;NH4++H2O NH3·H2O
+ H+
(3) NH4+, NH2–,OH–, H3O+等
(4)N2O3
课后练习:
| 1B | 2D | 3C |
4. (1) Mg, Al, S, Cl, Ca
(2) Mg
+S![]() MgS
Ca +Cl2
MgS
Ca +Cl2![]() CaCl2
CaCl2
5. (1) 略 (2) OH–,NH3, H2O