第三章 有机化合物
第三讲 生活中两种常见的有机物
复习重点:官能团的概念、乙醇、乙酸的组成、乙醇的取代反应与氧化反应、乙酸的酸
性和酯化反应。
复习难点:使学生建立乙醇和乙酸分子的立体结构模型,并能从结构角度初步认识乙醇
的氧化、乙酸的酯化两个重要反应。
知识梳理
一、乙醇、乙酸组成结构
1、乙醇:分子式:___;结构式: ____;结构简式:____或_____。官能团是
2、乙酸:分子式:___;结构式:_____; 结构简式:_____。官能团是_____。
二、化学性质
1.乙醇化学性质
(1)与金属钠的反应化学方程式 ;
(2)与氧气的反应化学方程式: ;
(3)在焊接铜漆包线的线头时,常把线头放在火上烧一下,以除去漆层,并立即在酒精中蘸一下再焊接,这是因为(用化学方程式表示):
① ②
(4)钠分别与水、乙醇反应的比较
| 钠与水的反应实验 | 钠与乙醇的反应实验 | |
| 钠的现象 | ||
| 声的现象 | 有“啧啧”的声音 | 无任何声音 |
| 气的现象 | 观察不到气体的现象 | 有无色、无味气体生成,作爆鸣实验时有爆鸣声 |
| 实验结论 | 钠的密度小于水的密度,熔点低。钠与水剧烈反应,单位时间内放出的热量大,反应生成氢气。2Na + 2H2O == 2NaOH +H2↑水分子中氢原子相对较活波 | 钠的密度大于乙醇的密度。钠与乙醇缓慢反应生成氢气。2Na + 2C2H5OH→ 2C2H5ONa + H2↑乙醇分子里羟基氢原子相对不活泼 |
| 反应实质 |
(5) 乙醇的分子结构与化学性质的关系

2、乙酸化学性质
(1)与CaCO3的反应化学方程式: ;
(2)乙酸的酸性比碳酸的 ;与乙醇的酯化反应化学方程式: ;酯化反应是 反应,反应进行的比较缓慢,反应物不能完全变成生成物;为防爆沸需加入 ,为了提高反应速率,一般要加入做催化剂,并加热。
(3) 酯化反应实质:有机羧酸脱___,醇脱______。
疑难点拨
一、羟基与氢氧根的区别
| 名称 区别 | 羟基 | 氢氧根 |
| 电子式 |
|
|
| 电性 | 不显电性 | 显负电性 |
| 稳定程度 | 不稳定 | 较稳定 |
| 存在 | 不能独立存在,与其他基相结合在一起 | 能独立存在 |
二、醇的催化氧化发生条件和规律
1、发生条件:醇分子结构中与—OH相连的碳原子上至少要有一个氢原子,即具有![]() 的结构。因为醇的催化氧化,其实质是“去氢”。
的结构。因为醇的催化氧化,其实质是“去氢”。
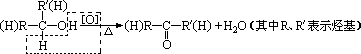
在有机反应中,氧化反应是指有机物去氢或加氧的反应,上述氧化反应也可通过碳元素的平均价态的变化来理解。
![]()
2、规律
(1)—OH连在链端点碳原子上的醇,即R—CH2OH结构的醇,被氧化成醛。
![]()
(2)与—OH相连碳原子上只有一个氢原子的醇,即![]() 结构的醇,被氧化成酮(
结构的醇,被氧化成酮(![]() ,其中R、R′为烃基,可同,可不同)。
,其中R、R′为烃基,可同,可不同)。
![]()
(3)与—OH相连碳原子上没有氢原子的醇,即![]() 结构的醇(R、R′、R″为烃基,可相同可不同),不能被催化氧化。
结构的醇(R、R′、R″为烃基,可相同可不同),不能被催化氧化。
∵ ![]() 不能形成
不能形成![]() 。
。
三、醇消去反应发生的条件
1、醇分子结构:与—OH相连的碳必须有相邻的碳原子,且此相邻的碳原子上还必须连有氢原子时,才能发生消去反应。
即:![]()
如: 都不能发生消去反应。
都不能发生消去反应。
2、反应条件:浓H2SO4,加热 。
二、实验室里制取乙酸乙酯时的注意事项:
1、化学原理:浓硫酸起催化脱水作用。
2、装置:液-液反应装置。用烧瓶或试管。试管倾斜成45°(使试管受热面积大)。弯导管起冷凝回流作用。导气管不能伸入饱和Na2CO3溶液中(防止Na2CO3溶液倒流入反应装置中)。
3、饱和Na2CO3溶液的作用。①.乙酸乙酯在饱和Na2CO3溶液中的溶解度较小,减小溶解,利于分层。②挥发出的乙酸与Na2CO3反应,除掉乙酸;挥发出的乙醇被Na2CO3溶液吸收。避免乙酸特殊气味干扰乙酸乙酯的气味。
典例剖析
【例1】 某有机物分子式是C3H4O2,它的水溶液显酸性,既能跟碳酸钠溶液反应,能使溴水褪色。写出这种有机物的结构简式。
解析:分子中含有两个氧原子,水溶液呈酸性,能跟碳酸钠溶液反应,应属于羧酸。从分子中氢原子数看,烃基不饱和,使溴水褪色发生的是加成反应。可判断分子中含有不饱和碳碳键和羧基。答案:CH2==CHCOOH。
【例2】下列化合物中,既显酸性,又能发生酯化反应和消去反应的是
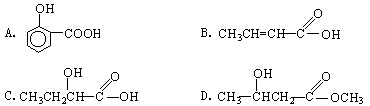
解析:根据各类官能团的性质判断:"-COOH"显酸性,"-COOH"和"-OH"能发生酯化反应,含有"-OH"或"-X"的能发生消去反应。综合判断,只有C符合题意。
【例3】将质量相等的下列各物质完全酯化时,需醋酸质量最多的是
A.甲醇 B.乙二醇 C.丙醇 D.甘油
解析:若某醇质量为1g,该醇分子量为M,该醇分子量含有x个羟基。则1g该醇含羟基(也即酯化时需羧基或醋酸)物质的量为:![]() , 比较4种醇
, 比较4种醇![]() 值,即可判断出正确答案。
值,即可判断出正确答案。
![]() ,可见,相等质量的4种醇中,甘油酯化消耗的醋酸最多。故正确答案为D。
,可见,相等质量的4种醇中,甘油酯化消耗的醋酸最多。故正确答案为D。
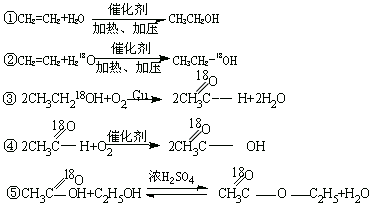
【例4】怎样以H2O、H218O、空气、乙烯为原料制取![]() ?写出有关反应的化学方程式。
?写出有关反应的化学方程式。
解析:解题时,可采用从最终的目标产物倒推原料(或中间产物)的方法。如:
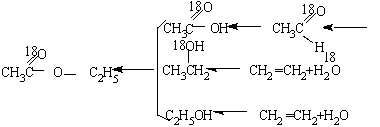
答案: 有关反应的化学方程式为:
知能练习
一、选择题
1.碳氢化合物是大气污染物之一,下列现象的产生与碳氢化合物有关的是 ( )
A.臭氧空洞 B.光化学烟雾 C.酸雨 D.火山爆发
2.科学家正在研究开发新的能源。“绿色能源”目前是研究的新能源之一,高粱、玉米等绿色植物的种子经发酵、蒸馏就可以得到一种“绿色能源”。这种物质是 ( )
A.氢气 B.甲烷 C.酒精 D.木炭
3.下列有关乙醇的物理性质的应用中不正确的是 ( )
A.由于乙醇的密度比水小,所以乙醇中的水可以通过分液的方法除去
B.由于乙醇能够溶解很多有机物和无机物,所以可用乙醇提取中草药的有效成分
C.由于乙醇能够以任意比溶解于水,所以酒厂可以勾兑各种浓度的酒
D.由于乙醇容易挥发,所以才有俗语“酒好不怕巷子深”的说法
4.关于乙醇结构方面的说法中正确的是 ( )
A.乙醇结构中有-OH,所以乙醇溶解于水,可以电离出OH-而显碱性
B.乙醇与乙酸反应生成乙酸乙酯,所以乙醇显碱性
C.乙醇与钠反应可以产生氢气,所以乙醇显酸性
D.乙醇与钠反应非常平缓,所以乙醇羟基上的氢原子不如水中的氢原子活泼
5.下列反应属于取代反应的是 ( )
A.CH4+2O2![]() CO2+2H2O
CO2+2H2O
B.CH2== CH2+Br2![]() BrCH2CH2Br
BrCH2CH2Br
C.CH3CH2CH2Cl+NaOH![]() CH3CH== CH2+NaCl+H2O
CH3CH== CH2+NaCl+H2O
D.![]() +H2O
+H2O![]()
![]() +HCl
+HCl
6.95% 的乙醇(密度为 0.78g·cm—3)用等体积的蒸馏水稀释后,所得溶液中乙醇的质
量分数最接近于 ( )
A.42% B.48% C.51% D.65%
7.下列是有关生活中对醋酸的应用,其中主要利用了醋酸酸性的是 ( )
A.醋酸溶液可一定程度上治疗手足癣 B.熏醋可一定程度上防止流行性感冒
C.醋可以除去水壶上的水垢 D.用醋烹饪鱼,除去鱼的腥味
8.下列物质中不能用来从碘水中提取碘单质的是 ( )
A.乙醇 B.苯 C.四氯化碳 D.乙酸
9.酯化反应是有机化学中的一类重要反应,下列对酯化反应理解不正确的是( )
A.酯化反应的反应物之一肯定是醇 B.酯化反应一般需要脱水
C.酯化反应是有限度的 D.酯化反应一般需要催化剂
10.为使95%的乙醇变为无水乙醇,工业上常常加入一种物质,然后蒸馏,这种物质可
以是 ( )
A.冰醋酸 B.熟石灰 C.生石灰 D.浓硫酸
11.将铜丝放在酒精灯火焰上加热后,分别再将其放入下列溶液中,取出洗涤、干燥后
质量没有变化的是 ( )
A.水 B.乙醇 C.醋酸 D.硫酸
12.能够用来检验酒精中是否含有水的试剂是 ( )
A.金属钠 B.无水硫酸铜 C.无水氯化钙 D.浓硫酸
13.能够用来鉴别乙醇、乙酸和苯的物质 ( )
A.钠 B.氢氧化钠溶液 C.水 D.紫色石蕊试液
14.水是一种廉价而且非常有用的试剂,下列用水就能鉴别的一组物质是 ( )
A.苯、乙酸、四氯化碳 B.苯、乙醇、四氯化碳
C.硝基苯、乙醇、四氯化碳 D.硝基苯、乙醇、乙酸
15.钠与下列物质反应都能够产生氢气:①H2O;②CH3COOH;③CH3CH2OH。试推断这三种
物质电离出H+的难易程度(从难到易的顺序) ( )
A.①②③ B.②③① C.③①② D.②①③
16.燃烧2mol某有机物,可以收集到标准状况下89.6L的CO2和6mol的H2O,试推断该
有机物的分子式是 ( )
A.C2H4 B.C2H4O C.C2H6 D.C2H6O
17.下列涉及有关乙酸的物理性质知识的叙述中不正确的是 ( )
A.食醋的颜色(红褐色)就是乙酸的颜色
B.乙酸的熔点比水高,很容易变成固体
C.醋酸是一种具有强烈刺激性气味的液体
D.乙酸和乙醇可以互溶故不能用分液法分离
18.将 1mol 乙醇(其中的氧用 18O 标记)在浓硫酸存在条件下与足量乙酸充分反应。
下列叙述不正确的是 ( )
A.生成的乙酸乙酯中含有18O B.生成的水分子中含有18O
C.可能生成 88g 乙酸乙酯 D.不可能生成 90g 乙酸乙酯
二、填空题
19.司机是否酒后驾车,可通过对其呼出的气体进行检验而查出,所利用的化学反应如下:2CrO3(红色)+3C2H5OH+3H2SO4===Cr2(SO4)3(绿色)+3CH3CHO+6H2O
被检测的气体的成分是________,上述反应中的氧化剂是__________,还原剂是__________。
20.有效地利用现有能源和开发新能源已受到各国的普遍重视。
(1)可用改进汽油组成的办法来改善汽油的燃烧性能,例如,加入CH3OC(CH3)3来生产“无铅汽油”。CH3OC(CH3)3分子中必存在的原子间连接形式有________(填写编号)。
①C==O ②![]() ③
③ ④
④
(2)天然气的燃烧产物无污染、热值高、管道输送方便,将成为我国西部开发的重点之一。天然气常和石油伴生,其主要成分是__________。能说明它是正四面体而非正方形平面结构的理由是__________(填写编号)。
①其一氯代物不存在同分异构体 ②其二氯代物不存在同分异构体
③碳原子与氢原子之间以共价键结合 ④四个碳氢键是完全等价的
(3)1980年我国首次制成一辆燃氢汽车,乘员12人,以50 km·h-1行驶了40 km。为了有效发展民用氢能源,首先必须制得廉价的氢气。下面可供开发又较经济的制氢方法是__________(填写编号)。
①电解水 ②锌和稀硫酸反应 ③光解海水
其次,制得氢气后还需要解决的问题是________(写出其中一个)。
21.2001年6月21日,河南的郑州、洛阳及南阳市率先使部分汽车采用封闭运行方式,试用新的汽车燃料——车用乙醇汽油。乙醇,俗名酒精,它是以玉米、小麦、薯类等为原料经发酵、蒸馏而制成的。乙醇进一步脱水,再加上适量汽油后形成变性燃料乙醇。而车用乙醇汽油就是把变性燃料乙醇和汽油按一定比例混配形成的车用燃料。结合有关知识,回答以下问题:
(1)乙醇的结构简式为__________。汽油是由石油分馏所得的低沸点烷烃,其分子中的碳原子数一般在C5~C11范围内,如戊烷,其分子式为_______________,结构简式及其同分异构体分别为__________、__________、__________。
(2)乙醇可由含淀粉〔(C6H10O5)n〕的农产品如玉米、小麦、薯类等经发酵、蒸馏而得。请写出由淀粉制乙醇的化学方程式:
①淀粉+水![]() 葡萄糖(C6H12O6)
葡萄糖(C6H12O6)
②葡萄糖![]() 乙醇
乙醇
(3)淀粉可由绿色植物经光合作用等一系列生物化学反应得到,即水和二氧化碳经光合作用生成葡萄糖,由葡萄糖再生成淀粉。进行光合作用的场所是___________,发生光合作用生成葡萄糖的化学方程式是________________________。
(4)乙醇充分燃烧的产物为________和________。
(5)车用乙醇汽油称为环保燃料,其原因是_________________________。
参考答案:
1、B 2、C 3、A 4、D 5、D 6、A 7、C 8、A 9、B 10、C 11、B 12、B 13、A 14、A 15、D 16、D 17、A 18、B
19、C2H5OH CrO3 C2H5OH
20、(1)③(2)甲烷 ②(3)③ 氢气的运输和贮存
21、(1)C2H5OH C5H12 CH3—CH2—CH2—CH2—CH3 ![]()
(2)①(C6H10O5)n+nH2O![]() nC6H12O6
nC6H12O6
②C6H12O6 ![]() 2C2H5OH +
2CO2 ↑
2C2H5OH +
2CO2 ↑
(3)叶绿体 6CO2+6H2O![]() C6H12O6+6O2
C6H12O6+6O2
(4)CO2 H2O
(5)能有效降低汽车尾气带来的严重大 气污染,改善环境质量