2006年杭州市第一次高考科目教学质量检测
化学试题卷
考生须知:
1.本卷满分100分,考试时间100分钟。
2.答题前,在答题卷密封区内填写学校、班级和姓名。
3.所有答案必须写在答题卷上,写在试卷上无效。
4.考试结束,只需上交答题卷。
可能用到的数据:lg2=0.3 lg5=0.7
相对原子质量H 1 C 12 N 14 O 16 S 32 Cl 35.5 Cu 64
一、选择题(每小题只有一个选项符合题意,每小题2分,共16分)
1.从石油中提取的矿物燃料燃烧后,产生的气体对环境会造成污染。为减少汽车尾气对大气的污染,1998年我国成功地制造出以新燃料作能源的“绿色汽车”,这种新燃料是
(A)90号汽油 (B)甲醇 (C)92号汽油 (D)0号柴油
2.“纳米材料”是当今材料科学研究的前沿课题,其研究成果广泛应用于医学及军事科学中。“纳米材料”是指研究、开发出的材料的直径从几纳米至几十纳米(1nm=10-9m)。如将这种材料分散到液体分散剂中,所得混合物具有的性质是
(A) 能全部透过半透膜 (B) 具有丁达尔现象
(C) 所得物质一定是浊液 (D) 所得物质一定是溶液
3.“若在宇宙飞船的太空实验室(失重条件下)进行以下实验,其中最难完成的是
(A)将金粉和铜粉混合 (B)将牛奶加入水中混合
(C)蒸发食盐水制取食盐晶体 (D)用漏斗、滤纸过滤除去水中的泥沙
4.已知气体的密度与它的摩尔质量成正比,一只汽球若放在空气中静止不动,那么在相同条件下,该气球放在下列气体中会下沉的是
(A)O2 (B)Cl2 (C)CO2 (D)H2
5.最新科技报导,美国夏威夷联合天文中心的科学家发现了新型氢微粒,这种新微粒是由3个氢原子核(只含质子)和2个电子构成,对于这种微粒,下列说法中正确的是
(A)是氢的一种新的同素异形体 (B)是氢的一种新的同位素
(C)它的组成可用H3表示 (D)它比一个普通H2分子多一个氢原子核
6.市场上有一种加酶洗衣粉,即在洗衣粉中加入少量的碱性蛋白酶,它的催化活性很强,衣物的汗渍、血迹及人体排放的蛋白质油渍遇到它,皆能水解而除去,下列衣料中不能用加酶洗衣粉洗涤的是:①棉织品;②毛织品;③腈纶织品;④蚕丝织品;⑤涤纶织品;⑥锦纶织品
(A)①②③ (B)②④ (C)③④⑤ (D)③⑤⑥
7.将0.05mol下列物质置于500mL水充分搅拌后,溶液中阴离子数目最多的是
(A)NH4Br (B)K2SO4 (C)Na2S (D)Mg(OH)2
|
2Cu2O+Cu2S 6Cu+SO2↑对于该反应,下列说法正确的是
(A)该反应的氧化剂只有Cu2O
(B)Cu既是氧化产物,又是还原产物
(C)Cu2S在反应中既是氧化剂,又是还原剂
(D)还原产物与氧化产物的物质的量之比为1:6
二、(每小题只有一个选项符合题意,每小题3分,共24分)
9.铜的摩尔质量为μ(kg/mol),密度为ρ(kg/m3)。若阿伏伽德罗常数为NA,则下列说法中哪个是错误的
(A) 1m3铜所含的原子数目是ρNA/μ (B)1kg 铜所含的原子数目是ρNA
(C)一个铜原子的质量是(μ/NA)kg (D)一个铜原子占有的体积是(μ/ρNA)m
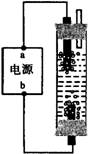 10.某学生想制作一种家用环保型消毒液发生器,用石墨作电极电解饱和氯化钠溶液,通电时,为使Cl2被完全吸收,制得有较强杀菌能力的消毒液,设计了如图的装置,则对电源电极名称和消毒液的主要成分判断正确的是
10.某学生想制作一种家用环保型消毒液发生器,用石墨作电极电解饱和氯化钠溶液,通电时,为使Cl2被完全吸收,制得有较强杀菌能力的消毒液,设计了如图的装置,则对电源电极名称和消毒液的主要成分判断正确的是
(A) a为正极,b为负极;NaClO和NaCl
(B) a为负极,b为正极;NaClO和NaCl
(C) a为阳极,b为阴极;HClO和NaCl
(D) a为阴极,b为阳极;HClO和NaCl
11.金属机械加工后的废切削液中含2%—5%NaNO2,直接排放会造成环境污染,下述试剂中可能使其转化为N2的是
(A)HNO3 (B)(NH4)2SO4 (C)Na3PO4 (D)浓H2SO4
12.在烧杯中加入水和苯(密度:0.88 g/cm3)各50 mL。将一小粒金属钠(密度:0.97 g/cm3)投入烧杯中。观察到的现象可能是
(A)钠在水层中反应并四处游动
(B)钠停留在苯层中不发生反应
(C) 钠在苯的液面上反应并四处游动
(D)钠在苯与水的界面处反应并可能作上、下跳动
13.最近,科学家冶炼出了纯度高达99.9999%的铁,根据所学化学知识判断该铁可能具有的性质有
(A)与相同浓度的盐酸反应生成氢气的速率比生铁快
(B)硬度比生铁高
(C)相同条件下比生铁易被腐蚀
(D)在冷的浓硫酸中可钝化
14.下列离子方程式中正确的是
(A)向NaHSO4溶液中逐滴加入Ba(OH)2溶液,至SO42-沉淀完全:
2H++SO42-+Ba2++2OH-= BaSO4↓+2H2O
(B)碳酸钠与醋酸溶液反应:CO32-+2H+ = CO2↑+H2O
(C)氢氧化亚铁与硝酸混合;Fe(OH)2+2H+ = Fe2++2H2O
(D)将1 mL~2 mL氯化铁饱和溶液滴加到20 mL沸水中:
Fe3++3H2O ![]() Fe(OH)3(胶体)+3H+
Fe(OH)3(胶体)+3H+
|
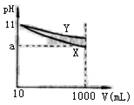
pH与溶液体积(V)的关系如右图所示,下列说法正确的是
(A)X、Y两种碱的物质的量浓度一定相等
(B)稀释后,X溶液碱性比Y溶液碱性强
(C)若9<a<11,则X、Y都是弱碱
(D)完全中和X、Y两溶液时,消耗同浓度盐酸的体积VX>VY
|
·HCl
下列说法不正确的是
(A)易蒙停的分子式为C29H34Cl2N2O3
(B)向易蒙停中加入FeCl3溶液,溶液显紫色
(C)1mol 易蒙停只能与1 mol NaOH反应
(D)易蒙停能与溴水发生反应
三、(本题包括3小题,共17分)
17.(4分)现有下列元素性质的数据:
|
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 |
| 最高或最低化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| -2 | -3 | -1 | -3 |
请确定以上8种元素在周期表中的位置,将元素的编号填入下表中:
|
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | ||||||||
| 2 | ||||||||
| 3 |
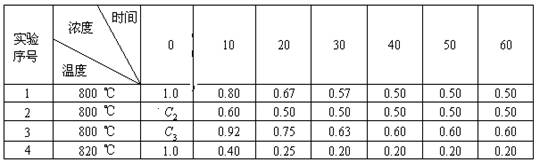
18.(7分)在溶液中进行某化学反应2A![]() B+D在四种不同条件下进行,B、D起始浓度为零,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
B+D在四种不同条件下进行,B、D起始浓度为零,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
根据上述数据,完成下列填空:
(1)在实验1,反应在10min~20min时间内平均速率(VA)为 mol/(L·min)。
(2)在实验2,A的初始浓度C2= mol/L,反应经20min就达到平衡,可推测实验2中还隐含的条件是 。
(3)设实验3的反应速率为v3,实验1的反应速率为v1,则v3 v1(填“>”、“=”、“<”),且C3 1.0 mol/L(填“>”、“=”、“<”)
(4)比较实验4和实验1,可推测该反应是 反应(选填吸热、放热)。理由是 。
19.(6分)在铝表面着色,先应用电解法使铝表面附上一层氧化铝,其方法将铝件作阳极,铁作阴极,用碳酸氢钠作电解液,进行电解。其原理是,通电后在铝件与电解液的接触面上逐渐形成一层Al(OH)3薄膜,薄膜的某些部位存在着小孔,电流从小孔通过并产生热量使Al(OH)3分解,从而在铝件表面形成一层较厚的氧化膜。
试回答:
(1)铝件表面形成氢氧化铝薄膜的电极反应式和离子反应式为:
(2)电解过程中,必须使电解液pH保持相对稳定(不能太大,也不能太小)的原因是 。
(3)使用NaHCO3溶液为电解液,会减缓阴极区溶液pH的增大,能说明这一原理的离
子方程式为 。
四、(本题包括2小题,共14分)
20.(6分)某学生将H2O2溶液滴入含有酚酞的NaOH溶液中,观察到溶液的红色消失。为了探究溶液褪色的原因,该同学查阅了资料:“过氧化氢(H2O2)是一种无色粘稠液体,有较强的氧化性,它的水溶液俗称双氧水,呈弱酸性。过氧化氢贮存时会分解为水和氧气。如在它的水溶液中加入少量二氧化锰,可以极大地促进它的分解。因此实验室里常用过氧化氢来制取氧气。”据此,该同学对溶液褪色的原因作出了两种假设,然后他又通过设计一个简单的实验,对这两种假设作了验证,证实有一种假设可能是错误的。
请回答:
(1)该同学作出的两种假设是什么?
(2)该同学设计了一个什么实验来证实其中一种假设可能是错误的?(说出该实验的方法及根据哪些现象作出判断)
21.(8分)已知常温常压下CO2在水中的溶解度不大,CO2与NaOH溶液反应时没有明显现象,某研究小组同学,设计了下图A—E五套装置,欲利用这些装置,能通过观察到的明显的现象,间接证明CO2与NaOH溶液发生了反应。
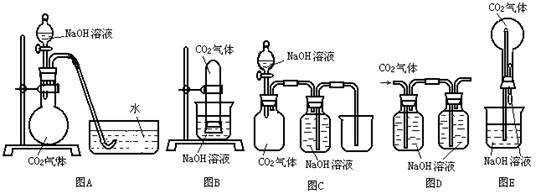
请选择以上实验装置,同时指出操作方法和观察到的实验现象,将答案填入下表:(表中已有一个示例)
| 所选装置 | 操 作 方 法 | 实 验 现 象 |
| B | 将充有CO2试管的橡皮塞打开 | 水槽中NaOH溶液上升到试管中 |
五、(本题包括2小题,共15分)
![]()
22.(5分)结构为 的物质与等物质的量的溴发生1,2加成反应或
1,4加成反应时,生成的加成产物有多种,写出这些加成产物的结构简式 。
![]() 23.(10分)A、B、C、D均为含苯环的化合物,且式量B>A>C,已知有机物A的结构简式为:
23.(10分)A、B、C、D均为含苯环的化合物,且式量B>A>C,已知有机物A的结构简式为:
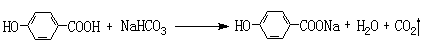
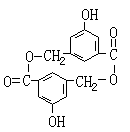 (1)A既能和NaOH溶液反应,又能和NaHCO3溶液反应,写出A和NaHCO3溶液反应的化学方程式
。
(1)A既能和NaOH溶液反应,又能和NaHCO3溶液反应,写出A和NaHCO3溶液反应的化学方程式
。
(2)有机物B在浓H2SO4存在条件下,相互作用生成一种环状酯
(如右图)
则有机物B的结构简式为 。
等物质的量B与Na、NaOH、NaHCO3充分反应,消耗Na、NaOH、
NaHCO3的物质的量之比为 。
(3)D和B互为同异构体,且知苯环上的一氯代物只有两种,D不与NaHCO3反应,能与Na和NaOH反应,等质量的D消耗Na和NaOH的物质的量比为2:3,则D的结构简式为 。(只写一种)
(4)1molA、C完全燃烧,消耗O2的质量相等,且1 molC能和1 molNa完全反应,写出含碳原子数最少的C的结构简式 。
六、(每题包括2小题,共14分)
24.(8分)下表是某温度下测得某酸溶液的一些数据,由表中的数据填空
| 溶液的物质的量浓度/mol·L-1 | 电离度/% | H+的物质的量浓度/mol·L-1 | pH |
| 0.1 | 2α | c1 | x |
| c | α | 2c1 | 3 |
则c == ; α== ; c1 == ; x ==
25.(6分)某CuO粉末与适量的硫酸(ρ=1.7g·cm-3)在微热下充分反应,冷却后恰好全部形成CuSO4·5H2O(设反应过程中无水份损失)。求此硫酸溶液的物质的量浓度。
2006年高考科目教学质量第一次检测
化学试题答题卷
| 题 序 | 一 | 二 | 三 | 四 | 五 | 六 | 总 分 |
| 得 分 |
一、选择题(每小题只有一个选项符合题意,每小题2分,共16分)
| 题 号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答 案 |

二、选择题(每小题只有一个选项符合题意,每小题3分,共24分)
| 题 号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答 案 |

三、(本题包括3小题,共17分)
17.(4分)
|
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | ||||||||
| 2 | ||||||||
| 3 |
18.(7分)
(1)
(2) ;
(3) ;
(4) ;
19.(6分)
(1)
(2)
(3)
 |
四、(本题包括2小题,共14分)
20.(6分)
(1)
(2)
21.(8分)
| 所选装置 | 操 作 方 法 | 实 验 现 象 |
| B | 将充有CO2试管的橡皮塞打开 | 水槽中NaOH溶液上升到试管中 |
 五、(本题包括2小题,共15分)。
五、(本题包括2小题,共15分)。
22.(5分)
23.(10分)
(1)
(2) ;
(3)
(4)
 |
六、(每题包括2小题,共14分)
24.(8分)
c == ; α== ; c1 == ; x ==
25.(6分)
2006年高考科目教学质量第一次检测
化学试题卷 参考答案及评分标准
一、选择题(每小题只有一个选项符合题意,每小题2分,共16分)
1.B 2.B 3.D 4.D 5.D 6.B 7.C 8.C
二、选择题(每小题只有一个选项符合题意,每小题3分,共24分)
9.B 10.B 11.B 12.D 13.D 14.D 15.C 16.C
三、(本题包括3小题,共17分)
17.(4分)
| ③ | ⑧ | ⑦ | ① | ||||
| ⑥ | ② | ④ | ⑤ |
(每空0.5分,总得分取整数)
18.(7分)
(1)0.013 (2)1.0;加入催化剂 (3)>;> (4)吸热;温度高A的浓度降低,说明升温平衡向正向移动,则正向是吸热反应。 (每空1分)
19.(6分)
(1)阳极:Al—3e-=Al3+ Al3++3HCO-3=Al(OH)3↓+CO2 (2分)
或Al+3HCO-3-3e-=Al(OH)3↓+CO2↑
(2)Al2O3、Al(OH)3均有两性,pH值太大或太小,都会使Al2O3薄膜溶解。(2分)
(3)OH—+HCO-3=CO2—3+H2O (2分)
四、(本题包括2小题,共14分)
20.(6分)
(1)假设一:过氧化氢有强氧化性,将酚酞氧化而使溶液褪色; (2分)
假设二:过氧化氢和氢氧化钠发生中和反应,而使酚酞不显色。(2分)
(2)可向褪色后的溶液中再加入NaOH溶液,使溶液呈碱性,若红色不再重现则假设二可能是错误的。 (2分)
21.(8分)
| 所选装置 | 操 作 方 法 | 实 验 现 象 |
| A | 将分液漏斗中的NaOH溶液滴入烧瓶 | 水槽中的水被吸入烧瓶中 |
| C | 通过分液漏斗向CO2气体的集气瓶中加入NaOH溶液 | 中间瓶中的NaOH溶液不能排入烧杯中 |
| D | 向左瓶中通入CO2气体 | 右瓶中无气泡冒出 |
| E | 将滴管中NaOH溶液挤入烧瓶中 | 产生喷泉现象 |
五、(本题包括2小题,共15分)
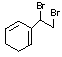
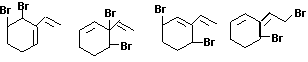 22.(5分)
22.(5分)
每写出一个给1分
23.(10分)
(1)
(2分)
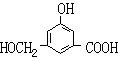 |
(2)B的结构简式为 (2分) 3:2:1(2分)
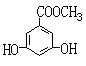 | 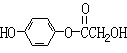 | ||
(3) D的结构简式为: 或 (2分)
(4)C的结构简式为 (2分)
六、(每题包括2小题,共14分)
24.(8分)
c =0.4; α=0.25; c1 =5×10-4; x =3.3 (每空2分)
25.(6分)
设生成1 mol CuSO4·5H2O,则相关反应为CuO+H2SO4+4H2O===CuSO4·5H2O
硫酸溶液的总质量为:98+18×4==170g
溶液的体积为 170÷1.7×10-3==0.1L
c(H2SO4)=1/0.1==10mol·L-1
本题找出n(H2SO4):n(H2O)=1:4即可得2分