练习三——氧化还原反应
一、基础知识整理:
1、概念:凡有 的化学反应就是氧化还原反应。
2、特征(判别方法): 。
3、本质:反应过程有 或 。
4、从微观粒子的角度认识电子转移与氧化还原的关系:
(1)氧化还原
氧化: 电子(化合价 )的变化。
还原: 电子(化合价 )的变化。
(2)氧化剂与还原剂
氧化剂: 电子(化合价 )的物质。
还原剂: 电子(化合价 )的物质。
(3)氧化产物与还原产物
氧化产物: 剂在反应中 电子后被氧化形成的生成物。
还原产物: 剂在反应中 电子后被还原形成的生成物。
5、几个概念之间的关系:
化合价升高→ 电子→被 →是 剂→具有 性。
化合价降低→ 电子→被 →是 剂→具有 性。
6、氧化还原反应与四大基本反应的关系:
| 化合反应 | 分解反应 | 置换反应 | 复分解反应 | |
| 是否是氧化还原反应 | ||||
| 反应举例 |
二、练习题:
1.有关氧[b1] 化还原反应实质的说法中正确的是 ( )
A.是否有元素的电子转移 B.是否有元素的化合价的变化
C.是否有氧元素的参加 D.是否有原子的重新组合
2.下列有[b2] 关四种基本反应类型与氧化还原反应关系的说法中正确的是 ( )
A.化合反应一定是氧化还原反应 B.分解反应一定不是氧化还原反应
C.置换反应一定是氧化还原反应 D.复分解反应不一定是氧化还原反应
3.下列有关实验[b3] 室制取气体的反应中,其原理不属于氧化还原反应的是 ( )
A.实验室中用稀硫酸与锌粒反应制取 H2
B.实验室中用高锰酸钾加热分解制取 O2
C.实验室中用浓盐酸与二氧化锰加热制取Cl2
D.实验室中用稀盐酸与石灰石反应制取CO2
4.下列化学反应中[b4] ,属于氧化还原反应的是 ( )
A.Na2CO3+CaCl2===CaCO3↓+2NaCl B.Fe+CuSO4===Cu+FeSO4
C.2NaHCO3![]() Na2CO3+CO2↑+H2O
D.CaO+H2O===Ca(OH)2
Na2CO3+CO2↑+H2O
D.CaO+H2O===Ca(OH)2
5.氧化还原反应[b5] 在生产、生活中具有广泛的用途。下列生产、生活中的事例不属于氧化还原反应的是()
A.金属冶炼 B.燃放鞭炮 C. 食物腐败 D.点制豆腐
6. 从硫元素的化合价态上判[b6] 断,下列物质中的硫元素不能表现氧化性的是 ( )
A.Na2S B. S C. SO2 D. H2SO4
7.下列说[b7] 法中,能够判断一个反应是否是氧化还原反应的是 ( )
A.反应前后,元素是否有电子转移 B.反应前后,元素是否有化合价变化
C.反应前后,是否有氧元素参加 D.反应前后,是否有氢元素参加
8.把3.6g铜[b8] 粉放入100mL 4mol·L—1硝酸溶液中,反应完全后被还原的硝酸的质量是 ()
A、7.2g B、10.8g C、6.3g D、2.4g
9.下列水溶液[b9] 中的各组离子因为发生氧化还原反应而不能大量共存的是 ( )
A.Na+、Ba2+、Cl-、SO42- B. Ca2+、HCO3-、C1-、K+
C.NO3-、K+、I-、H+ D. H+ 、Cl- 、Na+ 、CO32-
10.某单质能和浓[b10] 硝酸反应,若参加反应的单质与硝酸的物质的量之比为1∶4,则组成该单质的元素在产物中的化合价可能是 ( )
A.+1 B.+2 C.+3 D.+4
11.下列化学变化中,[b11] 需加入氧化剂才能实现的是 ( )
A.C→CO2 B.CO2→ CO C.CuO→Cu D.H2SO4→BaSO4
12.氧化还原反应发生在同[b12] 种元素之间的是 ( )
A.Zn+2HCl=ZnCl2+H2↑ B.2H2S+SO2=3S+2H2O
C.
H2+CuO=Cu
+H2O D.2H2O ![]() 2H2↑+O2↑
2H2↑+O2↑
13.下列反应中氯元素全[b13] 部被氧化的是 ( )
A.5Cl2+I2+6H2O=10HCl+2HIO3
B.2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
C.MnO2+4HCl=MnCl2+2H2O+Cl2↑
D.2NaCl+2H2O![]() 2NaOH+Cl2↑+H2↑
2NaOH+Cl2↑+H2↑
14.下列反[b14] 应中,电子转移发生在同种元素之间的是 ( )
A.2H2S+SO2=3S+2H2O
|
C.2KClO3 2KCl+3O2↑
D.Cu2O+H2SO4=CuSO4+Cu+H2O
15.氢化钙可以[b15] 作为生氢剂(其中CaH2中氢元素为-1价),反应方程式如下:
CaH2+2H2O=Ca(OH)2+2H2↑,其中水的作用是 ( )
A.既不是氧化剂也不是还原剂 B.是氧化剂
C.是还原剂 D.既是氧化剂又是还原剂
16.一定条[b16] 件下硝酸铵受热分解的化学方程式为:5NH4NO3=2HNO3+4N2+9H2O,在反应中被氧化与被还原的氮原子数之比为 ( )
A.5∶3 B.5∶4 C.1∶1 D.3∶5
17.在氧化[b17] 还原反应中,氧化剂______电子,发生的反应是_________反应;还原剂________电子,发生的反应是____________反应。铁与氯气反应的方程式为_________,生成物中铁是_______价,铁与盐酸的反应式为________,生成物中铁是________价,这一事实证明,氯气的氧化性比盐酸的氧化(“强”“弱”)____________。
18.火药是中国[b18] 的“四大发明”之一,永远值得炎黄子孙骄傲,也永远会激励着我们去奋发图强。黑火药在发生爆炸时,发生如下的反应:2KNO3+C+S===K2S+2NO2↑+CO2↑。其中被还原的元素是 ,被氧化的元素是 ,氧化剂是 ,还原剂是 ,氧化产物是 ,还原产物是 。
19.阅读下面两条科普[b19] 信息,回答问题:
(1)一个体重50Kg的健康人含铁2g,这2g铁在人体中不是以单质金属的形式存在,而是以Fe2+和Fe3+的形式存在。亚铁离子易被吸收,给贫血者补充铁时,应给予含亚铁离子的亚铁盐,如硫酸亚铁。服用维生素C,可使食物中的铁离子还原成亚铁离子,有利于铁的吸收。
(2)在新生代的海水里有一种铁细菌,它们提取海水中的亚铁离子,利用酶为催化剂把它转变成它们的皮鞘(可以用Fe2O3来表示其中的铁),后来便沉积下来形成铁矿;该反应的另一种反应物是CO2,反应后CO2转变成有机物(用甲醛:CH2O表示)。
问题:这两则科普信息分别介绍了人体内和海水中的亚铁离子与铁离子(或者铁的高价化合物)相互转化的事实、方法和途径。这说明亚铁离子具有 性,铁离子具有 性,(1)中的维生素C是 剂,(2)中的CO2 剂,写出(2)中的离子方程式 。
20.实验室中所用[b20] 少量氯气是用下列方法制取的,
4HCl(浓)+MnO2![]() Cl2↑+MnCl2+2H2O
Cl2↑+MnCl2+2H2O
试回答下列问题:
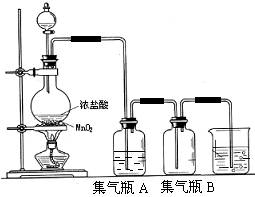
(1)该反应是氧化还原反应吗? ,如果是氧化还原反应,请指出 是氧化剂, 是还原剂,写出该反应的离子方程式 。
(2)集气瓶A中盛装的是饱和食盐水(注:氯气在饱和食盐水中溶解度很小,而氯化氢在饱和食盐水中的溶解度则很大),其作用是 。
(3)氯气溶入水显酸性,且氯气有毒,并有剧烈的刺激性,若吸入大量氯气,可中毒死亡,所以氯气尾气直接排入大气中,会污染环境。实验室中可采用 溶液来吸收有毒的氯气。
(4)一次实验中,用浓盐酸80mL,其密度为1.19g·cm-3、HCl的质量分数为36.5%,跟MnO2恰好完全反应,产生了5.6L(STP)的氯气。试计算浓盐酸的物质的量浓度和被氧化的HCl的物质的量。
21、六价的铬有剧毒[b21] ,所以要对含Cr(Ⅵ)(括号内罗马数字表示元素的价态,下同)废水进行化学处理,最常见的是铁氧磁体法,即把FeSO4·7H2O加入含Cr(Ⅵ)的废水中,在pH<4时,Fe2+还原Cr(Ⅵ)为Cr(Ⅲ)。调节溶液pH达8~10,使溶液中的Fe(Ⅱ)、Fe(Ⅲ)、Cr(Ⅲ)析出组成相当于FeⅡ[Fe![]() ·Cr
·Cr![]() ]O4(磁性材料铁氧体的组成)沉淀。试回答:
]O4(磁性材料铁氧体的组成)沉淀。试回答:
(1)若废水中,六价铬以Cr2O72-存在。试写出在酸性条件下硫酸亚铁还原Cr2O72-的离子方程式: 。
(2)由(1)的结果可确定铁氧磁体中x= 。
(3)据(2)的结果,若废水中Cr(Ⅵ)按CrO3计,则加入的FeSO4·7H2O与CrO3的质量比应为多少才能除去废水的Cr(Ⅵ),m(FeSO4·7H2O)/m(CrO3)= 。
[b1]A
[b2]C
[b3]D
[b4]B
[b5]D
[b6]A
[b7]AB
[b8]D
[b9]C
[b10]BD
[b11]A
[b12]B
[b13]CD
[b14]AD
[b15]B
[b16]A
[b17]得到 ;还原; 失去; 氧化; 2Fe+3Cl22FeCl3;+3;Fe+2HCl====FeCl2+H2↑;+2;强
[b18]氮和硫;碳;KNO3和硫;碳 ;CO2 ;K2S和NO2 。
[b19]还原性;氧化性;还原;氧化;CO2+4Fe2++5H2O=CH2O+3Fe2O3+8H+
[b20](1)是;MnO2;浓盐酸;4H++2Cl-+MnO2Cl2↑+Mn2++2H2O;
(2)除去氯气中混有的HCl气体 (3)浓氢氧化钠(浓碱)
(4)浓盐酸的物质的量浓度是:
被氧化的HCl的物质的量为:(5.6L/22.4L·mol-1)×2=0.5mol (提示:由化学反应方程式可知,氯气是氧化产物,1mol氯气生成,则有2mol的HCl被氧化)。
[b21](1)Cr2O72- +14H+ +6Fe2+ =2Cr3+ +6Fe3+ +7H2O (2) 1.5;(3)13.9