广安市高2006级“一诊”试题
化 学
注意事项:
1、全卷总分为100分,考试时间为100分钟。
2、本试卷共6页,分为第Ⅰ卷选择题和第Ⅱ卷非选择题两部分,第Ⅰ卷1至2页,第Ⅱ卷3至6页。
3、请将第Ⅰ卷正确答案填在第Ⅱ卷上的第Ⅰ卷答题栏内。考试结束。只交第Ⅱ卷。
4、答题时可能用到的相对原子质量:H—1 C—12 O—16 Cl—35.5 Mg—24
Al—27 Fe—56 Cu—64 N—14 Zn—65
第Ⅰ卷(选择题,共54分)
一、选择题(本题包括18小题,每小题3分,共54分。每小题只有一个选项符合题意)
1.我国东北发现日军侵华罪证之一——氯气弹,当氯气弹爆炸时
A. 人应躲到低洼有水的地方 B. 人应躲到较高的地方
C. 人应多饮牛奶和水 D. 可用软布浸KOH溶液蒙面
2.重铬酸铵[(NH4)2Cr2O7]受热发生氧化还原反应,下列各组重铬酸铵受热分解产物的判断符合实际的是
A. CrO3+NH3+H2O B. Cr2O3+NH3+H2O
C. CrO3+N2+H2O D. Cr2O3+N2+H2O
3.下列单质最容易跟H2发生反应的是
A. O2 B. Cl2 C. F2 D. N2
4.下列离子反应方程式书写正确的是
A. Na和水反应:![]()
B. AlCl3溶液通入过量氨气:![]()
C. SO2通入氯水溶液中:![]()
![]() D. Na2S溶液中
D. Na2S溶液中![]() 水解:
水解:![]() H2S+2OH-
H2S+2OH-
5.下列有关试剂保存方法,错误的是
A. 浓硝酸保存在无色的玻璃试剂瓶中
B. 少量的钠保存在煤油中
C. 氢氧化钠溶液保存于带橡皮塞的玻璃试剂瓶中
D. 新制的氯水通常保存在棕色的玻璃试剂瓶中
6.下列实验基本操作错误的是
A. 滴定管洗净后经蒸馏水润洗,即可注入标准液进行滴定
B. 玻璃棒蘸取溶液滴到放在表面皿上的PH试纸上
C. 玻璃导管蘸水后,边旋转边向橡皮管中插入
D. 加热坩锅中的硫酸铜晶体,失水后应置于干燥器中冷却,再称量
![]() 7.可逆反应mA(g)+nB(g)
xC(g)+yD(g),能够改变反应速率,同时能使平衡一定发生移动的条件是
7.可逆反应mA(g)+nB(g)
xC(g)+yD(g),能够改变反应速率,同时能使平衡一定发生移动的条件是
A. 浓度 B. 催化剂 C. 压强 D. 温度
8.下列分子中所有原子都满足最外层为8电子结构的是
A. SiF4 B. H2O C. BF3 D. PCl5
9.由钠、镁、铝、铁四种金属中的两种组成的混合物12g,与足量的盐酸反应,产生0.5molH2,则该混合物中一定不含
A. Na B. Mg C. Al D.Fe
10.100℃时,水的离子积常数Kw=10-12,该温度时,pH=4的AlCl3溶液中由水电离的H+浓度是
A. 10-8mol/L B. 10-10mol/L C. 10-5mol/L D. 10-4mol/L
![]() 11.在一定温度下,反应2SO2+O2 2SO3达到平衡时,n(SO2):n(O2):n(SO3)=2:3:4,
11.在一定温度下,反应2SO2+O2 2SO3达到平衡时,n(SO2):n(O2):n(SO3)=2:3:4,
缩小体积,反应再次达到平衡。n(O2)=0.8mol,n(SO3)=1.4mol,此时SO2的物质的量为
A. 0.4mol B. 0.6mol C. 0.8mol D. 1.2mol
12.某无色透明溶液能与铝反应放出H2,则该溶液中可大量共存的离子是
A. OH- Mg2+ ![]() Cl- B.
Cl- K+ Na+ Ba2+
Cl- B.
Cl- K+ Na+ Ba2+
C. Ba2+ Cl- Cu2+ ![]() D.
H+ Na+
D.
H+ Na+ ![]() Cl-
Cl-
13.下列除杂质的方法不可行的是
A. 用过量的氨水除去Al3+溶液中的少量Mg2+
B. 将混合气体通过灼热的铜网除去N2中少量的O2
C. 用MgCO3固体可除去酸性MgCl2溶液中少量的FeCl3
D. 除去FeCl3酸性溶液中少量的FeCl2,加入稍过量双氧水后放置
14.Cl2和SO2均能使品红褪色,下列说法正确的是
A. 等物质的量的Cl2和SO2同时通入品红溶液中,变色最快
B. 两者漂白原理相同
C. 将褪色的品红溶液加热,可区别是Cl2漂白还是SO2漂白
 D. 分别通入H2S溶液中,可区别Cl2和SO2
D. 分别通入H2S溶液中,可区别Cl2和SO2
15.下列各气体能用如右图所示装置收集的是
A. NO B. CO C. H2 D. Cl2
16.在水中加入等物质的量的Ag+、Ba2+、![]() 、
、![]() 、
、![]() ,将该溶液放入惰性材料作电极的电解槽中通电片刻,则氧化产物与还原产物的质量比为
,将该溶液放入惰性材料作电极的电解槽中通电片刻,则氧化产物与还原产物的质量比为
A. 35.5:10.8 B. 16:207 C. 8:1 D.108:35.5
17.25℃时,pH=2某酸(HA)与pH=12某碱(BOH)等体积混合后,混合液的pH=10,下列描述中正确的是
A. 若两者中有一种为强电解质,则一定是BOH
B. 若HA是强酸,混合液中离子浓度关系一定是![]()
C. 若混合液中存在离子水解,则一定是A-水解
D. 两者混合后,BOH有可能过量
18.已知三角锥形分子E和直线形分子G反应,生成两种直线形分子L和M,(组成E、G、L、M分子的元素原子序数均小于10)如下图,则下列判断错误的是
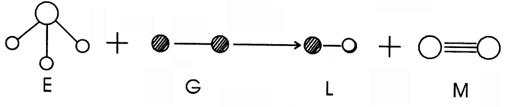
A. G是最活泼的金属单质 B. L是极性分子
C. E能使紫色的石蕊试液变成蓝色 D. M化学性质活泼
广安市高2006级“一诊”试题
化 学
注意事项:版权归四川省黄金屋文化传播有限责任公司所有
1、答第Ⅱ卷前,请先将密封线内相关项目填写清楚。
2、请将第Ⅰ卷的答案填在第Ⅱ卷上的第Ⅰ卷上的第答题栏内。
3、第Ⅱ卷共4页,请考生用蓝(黑)墨水笔直接在试卷上作答。考试结束只文第Ⅱ卷。
总 分 栏
| 题号 | 一 | 二 | 三 | 四 | 五 | 总分 | 总分人 |
| 布分 | 54 | 16 | 13 | 11 | 6 | 100 | |
| 得分 |
第Ⅰ卷答题栏
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 | |||||||||
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 |
第Ⅱ卷(非选择题,共46分)
| 得 分 | |
| 评卷人 |
二、填空题(16分)版权归四川省黄金屋文化传播有限责任公司所有
19.短周期的三种元素X、Y、Z,原子序数依次减小,原子核外电子层数之和是5,X元素原子最外电子层上的电子数是Y和Z两元素原子最外电子层上的电子数的总和;X元素原子可以与Z元素原子形成1:1的无机化合物,Y和Z可以形成YZ3的化合物。请回答:
(1)X元素是 ,Y元素是 ,Z元素是 。
(2)YZ3化合物的电子式是 ,它的空间构型是 (不画图,文字描述),是 (极性或非极性)分子。
(3)Y的最高价氧化物的水化物能与YZ3反应,写出反应的离子方程式:
(4)写出工业合成YZ3的化学方程式;
(注明条件)
| 得 分 | |
| 评卷人 |
三、推断题(13分)版权归四川省黄金屋文化传播有限责任公司所有
20.如图所示,各物质间存在如下相互转化关系,其中F为金属,能和氧化铁反应,生成单质。E和K为无色的气体单质,其它物质均为化合物,A为无色气体,C为无色液体,B是淡黄色固体。
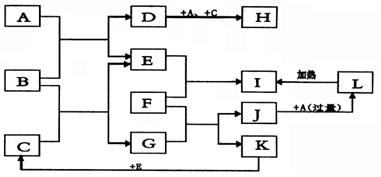
试回答下列问题:
(1)写出B的电子式 ,J的化学式 。
(2)F在元素周期表中 周期 族。
F能与下列物质反应放出H2的是 (只填序号)。
A. NH3•H2O B. 浓H2SO4 C. 稀HCl
D. KHSO4溶液 E. NaOH溶液 F. 稀HNO3
(3)写出F与G反应的离子方程式 ,J生成L的离子方程式 。
(4)分别写出下列反应的化学方程式:
①H固体转化为D:
②F与氧化铁反应:
| 得 分 | |
| 评卷人 |
四、实验题(11分)
版权归四川省黄金屋文化传播有限责任公司所有
21.某校化学小组学生利用下图所示装置进行“铁与水反应”的实验,并利用产物进一步制取FeCl3•6H2O晶体。(图中夹持及尾气处理装置均已略去)
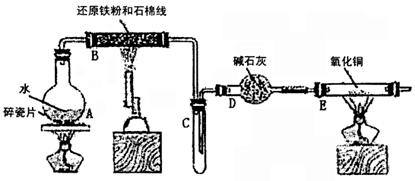
(1)装置B中发生反应的化学方程式是 。
(2)装置E中的现象是 。
(3)停止反应,待B管冷却后,取其中的固体,加入过量稀盐酸充分反应,过滤。简述检验滤液中Fe3+的操作方法:
(4)该小组学生利用上述滤液制取FeCl3•6H2O晶体,设计流程如下:
|
①步骤I中通入Cl2的作用是 。
②步骤II从FeCl3稀溶液中得到FeCl3•6H2O晶体的主要操作包括:
。
| 得 分 | |
| 评卷人 |
五、计算题(6分)版权归四川省黄金屋文化传播有限责任公司所有
22.现有一铝铁组成的合金,其物质的量为a mol,铝的物质的量分数为x,研成粉末状后全部投入500mL含b mol HNO3的稀溶液中,微热充分反应,粉末完全溶解,HNO3还原产物只有NO,试回答:
(1)当溶液中金属离子只有Al3+、Fe2+时,则b的值是(用a,x表示)
(2)当x=0.5溶液中Fe3+和Fe2+物质的量之比为2:3,收集标准状态下NO气体共4.032L,若溶液体积变化忽略,试求:a是多少?硝酸溶液物质的量浓度是多少?
广安市高2006级“一诊”试题
化学参考答案及评分标准
一、选择题(每小题只有一个答案,符合题意,每小题3分,共54分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 | B | D | C | C | A | A | D | A | B |
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 | D | A | B | A | C | D | C | D | D |
二、填空题:
19.(16分)(1)氧(或O),氮(或N),氢(或H)。
|
|
|
|
(3)NH3+H+=![]() (或NH3·H2O+H+=
(或NH3·H2O+H+=![]() +H2O)
+H2O)
(4)2+3H2![]() 2H3(每空2分)
2H3(每空2分)
三、推断题:
20.(13分)(1)Na+[![]() ]2-Na+ NaAlO2
]2-Na+ NaAlO2
(2)三,IIA,CDE(每空1分)
(3)2Al+2H2O+2OH-=2AO![]() +3H2↑Al O
+3H2↑Al O![]() +CO2+2H2O=HCO
+CO2+2H2O=HCO![]() +Al(OH)3↓(每空2分)
+Al(OH)3↓(每空2分)
(4)2NaHCO3![]() Na2CO3+CO2↑+H2O 2Al+Fe2O3
Na2CO3+CO2↑+H2O 2Al+Fe2O3![]() 2Fe+Al2O3(每空2分)
2Fe+Al2O3(每空2分)
四、实验题
21.(11分)(1)3Fe+4H2O(g)![]() Fe3O4+4H2 (3分)
Fe3O4+4H2 (3分)
(2)黑色固体变为红色固体,有小液滴产生。
(3)取滤液少许,滴入SKCN(或NH4SCN)溶液。
(4)①将溶液中Fe2+氧化成Fe2+;②蒸发,浓缩,结晶,过滤。(每空2分)
22.(6分)由Al+4HNO3=Al(NO3)3+NO↑+2H2O和3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O
知:![]() (2分)
(2分)
根据得失电子总数相等得:![]()
![]() (2分)
(2分)