![]() 2008届高考化学学业水平测试复习1
2008届高考化学学业水平测试复习1
(第一、二章)
(第一课时:化学基本概念)
教学目的:
1、 通过复习使学生准确地、深刻地理解基本概念。
2、 通过概括、整理,使学生形成相应的概念网络。
3、 清晰阐明了化学基本概念的重要性和学好化学基本概念的正确方法。
教学重点:
1、 通过概括、整理,使学生形成相应的概念网络。
2、 明确化学概念在以后学习中的重要性。
教学过程:
[引课]今天我们将第一章及第二章内容进行系统化归纳、整理。
[投影]
一、化学基本概念
化学基本概念包括:物质的组成、性质和分类;化学用语;化学中的常用计量;化学反应基本类型;溶液和胶体。
[板书] 一、化学基本概念
1、化学中常用计量—物质的量
[归纳]引导学生主动发言:回答物质的量定义;画出各概念之间的关系。
[投影]化学中常用计量指围绕物质的量展开的计算。物质的量是国际单位制中七个基本物理量之一,它表示物质所含的微粒个数,它的单位是摩尔。它可以与微粒数,物质质量,气体在标况下的体积,溶液的浓度之间进行换算,在高中化学计算中起桥梁作用,这几个概念之间网络关系如下:
 |
[强调]关于气体的问题,经常应用到阿佛加德罗定律和它的推论。同温同压下相同体积的任何气体具有相同的分子数,将它扩展,就是同温同压下,气体体积比等于它们的物质的量之比。因为气体的体积受分子数多少,分子间距离决定,在同温同压下,分子间距离相等。
[板书] 物质的量定义;各概念之间的关系。
例1、在无土栽培中,需配制一定量含50mol NH4Cl、16mol KCl和24mol K2SO4的营养液。若用KCl、NH4Cl和(NH4)2SO4三种固体为原料来配制,三者的物质的量依次是(单位为mol)
A、2、64、24 B、64、2、24
C、32、50、12 D、16、50、24
解析:先求出需配制营养液中所需NH4+、K+、Cl-、SO42-物质的量,再用同样的方法求出选项中所提供的物质中所含NH4+、K+、Cl-、SO42物质的量。若与题干中的数值一致,即为选项。如题干中NH4+:50mol;K+:16+24×2=64(mol);Cl-:50+16=66(mol);SO42-:24mol。选项B, NH4+:2+24×2=50(mol);K+:64mol;Cl-:64+2=66(mol);SO42-:24mol,与题干相符,选项B正确.
说明:解本题的原理,实质是利用质量守恒原理。如果题目中提供不是固体物质,而是溶液,其解法是相同的,只要将溶质的物质的量求出,就变成与本题完全相同的题目。目前化学试题中往往置于与生产实际、科研等相结合的情境中,解题时,只要把它迁移到解化学题基本方法中,就可迎刃而解。
2、溶液与胶体
[思考] 溶液、胶体、悬浊液、乳浊液 区别及胶体主要性质。
[投影](1)溶液、胶体、悬浊液、乳浊液 区别:
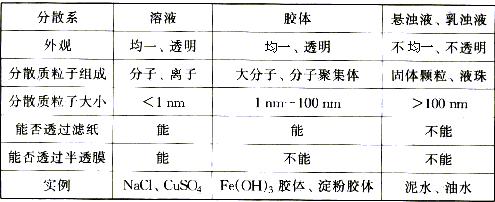
(2)胶体性质:丁达尔现象、布朗运动、电泳。
[板书] (1)溶液、胶体、悬浊液、乳浊液 区别(2)胶体性质:丁达尔现象、布朗运动、电泳。
例2、实验时,手不慎被玻璃划破,可从急救箱中取氯化铁溶液应急止血,其原因是_______,若换成硫酸铜溶液,是否可以?其原因是_________。
解答:血液是胶体,FeCl3是电解质,可使血液发生凝聚。不能用硫酸铜,因为铜盐有毒,虽然也能使血液凝聚,但不能使用。
[板书]3、氧化还原反应
(1)化学反应基本类型与氧化还原反应的关系
[思考回答]氧化还原反应定义及与化学基本类型的关系。
[投影]
有电子转移的反应是氧化还原反应,它的特征是元素的化合价发生变化。
(1)化学反应基本类型与氧化还原反应的关系
化合反应指两种或两种以上的物质生成一种物质的反应,有些属于氧化还原反应,有些属于非氧化还原反应。
分解反应指一种物质分解生成两种或两种以上其它物质的反应,有单质生成的分解反应是氧化还原反应,有些分解反应属于非氧化还原反应。
置换反应指一种单质和一种化合物生成另一种单质和另一种化合物的反应。置换反应都是氧化还原反应。
复分解反应指的是两种化合物相互起反应生成另外两种化合物的反应,发生复分解反应的条件是:有气体,沉淀或难电离物生成。这里的复分解反应主要指的是离子交换反应,不属于氧化还原反应。
例3、下列反应中,属于氧化还原反应的是
A、NH4HCO3=NH3↑+CO2↑+H2O
B、Na2CO3+2HCl=2NaCl+CO2↑+H2O
C、4HCl+MnO2=MnCl2+Cl2↑+H2O
D、2Cu(NO3)2=2CuO+4NO2↑+O2↑
分析:判断化学反应是否是氧化还原反应依据是反应前后有无元素化合价发生变化,选项A、B反应中均无元素化合价变化,因此是非氧化还原反应,C、D项反应中,元素化合价发生改变,C项中Mn从+4价降为+2价,部分Cl从-1价升高为0价,D项中N从+5价降为+4价,部分氧从-2价升高为0价,因此C、D属于氧化还原反应。答:C、D。
[思考并板书](2)氧化还原反应的有关概念及联系 。
[投影]
 还原剂有还原性 → 价升高 → 失电子 → 被氧化→发生氧化反应→产生氧化产物
还原剂有还原性 → 价升高 → 失电子 → 被氧化→发生氧化反应→产生氧化产物
(物质) (性质)(特征) (实质)(变价元素) (反应) (产物)
氧化剂有氧化性 → 价降低 → 得电子 → 被还原 →发生还原反应→产生还原产物
[强调]氧化还原反应中的概念大多是成对出现,在学习过程中,易出现混淆现象,若能将上述网络形式中点的概念联成线,对比记忆,是会收到事半功倍的效果的!
例4、下列变化过程中,在常温下加入还原剂就能实现的是( )
A、Ag+→Ag B、CuO→ Cu C、SO2→SO3 D、CO→CO2
分析:根据题意可知,该反应必须是氧化还原反应,而且已知物质只能作氧化剂,它在反应中元素化合价是降低的。对于A选项,Ag+→Ag化合价降低要实现此变化必须要加入还原剂,如在AgNO3溶液中加入Cu片,则可发生2AgNO3+Cu=Cu(NO3)2+2Ag的反应,A项符合题意,B项CuO→Cu,铜元素化合价降低,必然也要加入还原剂,如H2、CO、C等,但它们反应条件都必须是高温一般情况常温下几乎没有物质可使CuO变为Cu;C、D选项中,元素化合价是升高的,要实现此变化,要加入的是氧化剂,不符合题意。选A。
[板书]4、离子反应
[思考] 电解质的概念,离子反应发生的条件。
[投影](1)电解质的概念。凡在水溶液中或熔化状态下能导电的化合物叫电解质,在上述两种状态都不能导电的化合物叫非电解质。这里注意强调是化合物,象金属单质、石墨、溶液等都不在此范围。能否电离是电解质与非电解质的区别,而对于电解质来讲,电离的程度也不尽相同。
(2)离子反应指有离子参加的化学反应。离子反应包括两大类:①复分解反应,需要满足复分解反应的发生条件,一般情况下,向离子浓度减小的方向进行;②氧化还原反应。
[板书] 电解质的概念,离子反应发生的条件。
例5、下列反应既是离子反应,又是氧化还原反应的是
A.二氧化硫与硫化氢作用生成硫和水
B.二氧化硫与氢氧化钠溶液作用生成亚硫酸钠
C.硫化氢通入氯化铁溶液中生成硫、氯化亚铁和盐酸
D.Zn粒与稀硫酸反应制取氢气
分析:A、C、D化合价均发生变化,所以均为氧化还原反应。但只有C、D中有离子参加,所以选C、D。
例6、下列各组离子,能在溶液中大量共存的是
A.Ag+,K+,I-,NO3- B.Cu2+,H+,Br-,S2-
C.Mg2+,H+、Cl-,SO42- D.K+,H+,S2-,SO42-
分析:解这类题的思路是:不同的离子是否能在溶液中大量共存,主要从以下几个方面考虑:①离子相互结合成难溶(微溶)物质或气体;②离子相互结合成难电离物质;③离子间发生氧化还原反应。本题中A项,Ag+与I-结合成AgI沉淀,所以不能共存。B项中,Cu2+与S2-结合成CuS沉淀,所以也不能共存。C项中的4种离子均能共存。D项中,H+和S2-可以结合成难电离物质,所以也不能共存。答案:C。
[板书](3)离子反应方程式书写的注意事项:
[思考] 学生主动回答。
[投影]
(1)一般离子反应多发生在溶液中,故不是溶液中进行的反应,不能用离子方程式表示。
(2) 离子方程式中,只有可溶性强电解质方可拆成离子形式,其它物质均以化学式表示。如:单质、氧化物(包括H2O)、难溶物(CaCO3、BaSO4等)、气体、难电离(CH3COOH、HF、NH3·H2O等)都不能改写成离子形式。
(3)单质、氧化物均用化学式表示。
(4)关于微溶物:生成物中有微溶物析出时,写化学式;反应物里微溶物处于溶液状态时,可写成离子符号(如:澄清的石灰水,可写成Ca2+ 和OH- ),反应物里微溶物处于浊液或固体时,写化学式[如:石灰乳,应用Ca(OH)2表示].
(5)以反应为依据,尊重客观事实。
例7、下列离子方程式正确的是
A.铜片投入AgNO3溶液中Cu+Ag+=Cu2++Ag
B.少量氯气通入KI溶液中Cl2+I-=Cl-+I2
C.Ba(OH)2溶液中滴入稀H2SO4 Ba2++OH-+H++SO42-=BaSO4↓+H2O
D.Fe+2H+=Fe2+ +H2↑
分析:A.电荷不守恒,B.质量不守恒,C.中Ba2+与OH-、H+与SO42-的系数比不等于反应物的组成比。正确。解题方法为筛选法。常见错解为A或C。答案:D
例8、(1)向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至中性,请写出发生反应的离子方程式:______;
(2)在以上中性溶液中,继续滴加Ba(OH)2溶液,请写出此步反应的离子方程式:
分析: 向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至中性,说明NaHSO4和Ba(OH)2反应的物质的量之比为2∶1,其化学方程式为:
2NaHSO4+Ba(OH)2=BaSO4↓+Na2SO4+2H2O
离子方程式为:
2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
同样可得(2)的离子方程式为:
SO42-+Ba2+=BaSO4↓
离子反应是否发生,只要观察反应中某种离子浓度是否发生改变,只要有一种离子浓度改变,该反应即可发生。
答案:(1)2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O (2)SO42-+Ba2+=BaSO4↓
[课堂练习]
一、选择题
1.下列物质中属于电解质的是
A 石墨 B 食盐溶液 C 二氧化硫 D 硝酸钠
2、下列物质中属于非电解质的是
A 二氧化碳 B 铝 C 硫酸钡 D 蔗糖
3.下列反应中属于氧化还原反应的是:
A.CO2+H2O==H2CO3 B.H2CO3==CO2+H2O
C.CaCO3+2HCl==CaCl2+H2O+CO2 D.CO2+C==2CO
4.下列说法中正确的是:
A.氧化剂本身发生氧化反应 B.氧化还原反应一定有氧元素参加
C.氧化剂在反应中得电子,还原剂失去电子
D.氧化反应一定先于还原反应发生
5.实现下列变化,一定要加入其它物质作氧化剂的是:
A.CaCO3 → CO2 B.NaCl → NaNO3
C.Zn → ZnCl2 D.CuO → CuSO4
6、在下列化学方程式中,不能用SO42-+Ba2+=BaSO4↓来表示的是
A.Ba(NO3)2+H2SO4==BaSO4↓+2HNO3
B.BaCl2+Na2SO4==BaSO4↓+2NaCl
C.BaCO3+H2SO4==BaSO4↓+H2O+CO2↑
D.BaCl2+H2SO4==BaSO4↓+2HCl
7.下列离子方程式中,正确的是
A. 稀硫酸滴在铜片上:Cu+2H+==Cu2++H2↑
B. 硫酸钠溶液与碳酸钡溶液混合:SO42-+Ba2+=BaSO4↓
C、盐酸滴在石灰石上:CaCO3+2H+==Ca2++H2CO3
D、氧化铜与硫酸混合:Cu2++SO42-=CuSO4
8.下列说法中错误的是
A.置换反应一定是氧化还原反应 B.化合反应不可能是氧化还原反应
C.分解反应可能是氧化还原反应 D.凡是氧化还原反应,都不可能是复分解反应
9、氢化钙可作生氢剂:CaH2+2H2O=Ca(OH)2+2H2↑其中水的作用是
A.氧化剂 B.还原剂 C.氧化剂和还原剂 D.催化剂
二、填空题
10.氧化还原反应的本质是_____________,通常可用化合价的升降来判断氧化剂、还原剂。化合价升高的是______________剂,发生______________反应。
11.离子方程式是用______来表示______的式子。盐酸、硫酸等不慎沾在皮肤和衣物上,应立即用水冲洗,然后再用碳酸钠溶液冲洗,该反应的离子方程式是______。
12.电解质溶液之间的反应,实质上是______之间的反应。这类离子反应发生的条件,实质上就是______反应发生的条件,只要生成物中有______、______或______物质生成,反应就能够发生。
[参考答案]1、D 2、AD 3、D 4、C 5、C 6、C 7、C 8、B 9、A 10、电子的转移、还原、氧化11、实际参加反应的离子 化学反应 2H++CO32-=H2O+CO2↑12、酸、碱、盐 复分解 气体生成、沉淀生成、难电离物质生成