试卷类型:A
2003年MAM高考化学仿真试题(八)
MAM: M-March A-April M-May
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。第Ⅰ卷1至4页,第Ⅱ卷5至8页。共150分,考试时间120分钟。
第Ⅰ卷(选择题 共72分)
注意事项:
1.答第 Ⅰ 卷前,考生务必将自己的姓名、准考证号、考试科目、试卷类型用铅笔涂写在答题卡上。
2.每小题选出答案后,用铅笔把答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其他答案标号,不能答在试卷上。
3.考试结束后,考生将本试卷和答题卡一并交回。
可能用到的相对原子质量:C—12 H—1 O—16 Na—23 Ba—137 Al—27
一、选择题(本题包括8小题,每小题3分,共24分;每小题只有一个选项符合题意)
1.下列物质固态时,必定是分子晶体的是
A.酸性氧化物 B.非金属单质
C.碱性氧化物 D.含氧酸
2.由羟基分别跟下列基团相互结合所构成的化合物中,属于醇类的是

3.钾—钠合金(含50%~80%钾)可用作原子反应堆的导热剂,以下所述该合金的事实跟此项应用无关的是
A.能跟水剧烈反应 B.具有很高的比热
C.可作冷却剂 D.熔点260.7 K
4.下列物质中,可用于治疗胃酸过多的是
A.硫酸钡 B.氢氧化铝 C.氧化钙 D.碳酸钡
5.为了保护臭氧层,可采取的有效措施是
A.减少二氧化硫的排放量 B.减少氟氯代烃的排放量
C.减少含铅废气的排放量 D.减少二氧化碳的排放量
6.体积相同的某植物营养液两份,其配方如下:
|
编 号 | KCl | K2SO4 | ZnSO4 | ZnCl2 |
| (1) | 0.3mol | 0.2mol | 0.1mol | |
| (2) | 0.1mol | 0.3mol | 0.1mol |
两份营养液中各离子浓度
A.完全相同 B.完全不同
C.仅c(K+)相同 D.仅c(Cl-)相同
7.已知两瓶气体分别是HCl和Cl2,可以区别它们的方法或试剂是
①观察颜色 ②打开瓶盖看有无白雾 ③湿润的淀粉试纸 ④湿润的红色石蕊试纸 ⑤湿润的蓝色石蕊试纸 ⑥AgNO3溶液
A.①②③④ B.①②⑤⑥
C.①②④⑤ D.①②③⑥
8.浓度为0.5 mol·L-1的盐酸V L,欲使其浓度增大1倍,下列采取的方法正确的是
A.加入0.125 V L 5 mol·L-1的盐酸
B.通入标准状况下的HCl气体11.2 L
C.将溶液加热浓缩至0.5 L
D.加入10 mol·L-1的盐酸0.1 V L,再将溶液稀释至1.5V L
二、选择题(本题包括10小题,每小题5分,共50分;每小题有一个或两个选项符合题意)
9.在2 L的密闭容器中,把4 mol A和2 mol B混合,在一定条件下发生反应
3
A(g)+2 B(g)![]() xC(g)+2
D(g)。2 min后达到平衡时生成1.6
mol C,又测得反应速率v(D)=0.2
mol·(L·min)-1,下列说法正确的是
xC(g)+2
D(g)。2 min后达到平衡时生成1.6
mol C,又测得反应速率v(D)=0.2
mol·(L·min)-1,下列说法正确的是
A.B的转化率是20% B.x=4
C.A的平衡浓度是1.4 mol·L-1 D.平衡时气体压强是原来的0.94倍
10.若在化学实验中发生下列事故,处理方法正确的是
A.金属钠着火,用泡沫灭火器扑灭
B.苯酚沾在手上,应马上用NaOH溶液清洗
C.皮肤上沾上浓硫酸,应马上用布拭去,并立即用大量水冲洗
D.酒精灯在桌上歪倒失火后,立即用湿布盖上
11.钡和钠相似,也能形成含O![]() 的过氧化物,下列叙述中正确的是
的过氧化物,下列叙述中正确的是
A.过氧化钡的化学式是Ba22
![]()
C.1 mol过氧化钠或过氧化钡跟足量水反应都生成0.5 mol氧气
D.过氧化钠或过氧化钡都是强氧化剂
12.下列离子方程式错误的是
|
B.实验室制取氯气:MnO2+4H++2Cl-=====Mn2++2H2O+Cl2↑
C.向三氯化铁溶液中加入过量铜屑:2Fe3++Cu====2Fe2++Cu2+
D.用NaOH溶液吸收少量H2S气体:OH-+H2S====HS-+H2O
13.下列各组溶液混合后一定能产生沉淀的是
A.硝酸银溶液和氨水 B.氨水和氯化铝溶液
C.硫代硫酸钠溶液和稀硫酸 D.亚硫酸钠溶液和稀硝酸
14.含11.2 g KOH的稀溶液与1 L 0.12 mol/L的H2SO4溶液反应放出11.46 kJ的热量。该反应的热化学方程式是
A.KOH(aq)+![]() H2SO4(aq)====
H2SO4(aq)====![]() K2SO4(aq)+H2O(l)
K2SO4(aq)+H2O(l)
ΔH=-11.46 kJ/mol
B.2KOH(aq)+H2SO4(aq)=K2SO4(aq)+2H2O(g)
ΔH=-114.6 kJ/mol
C.2KOH(aq)+H2SO4(aq)=K2SO4(aq)+2H2O(l)
ΔH=-114.6 kJ/mol
D.KOH(aq)+![]() H2SO4(aq)=
H2SO4(aq)=![]() K2SO4(aq)+H2O(l)
K2SO4(aq)+H2O(l)
ΔH=-57.3 kJ/mol
|
A.电池放电时,电池负极周围溶液的pH不断增大
B.电池放电时,镍元素被氧化
C.电池充电时,氢元素被还原
D.电池放电时,H2是负极
16.某强酸性溶液中,含有大量的Fe2+、Ba2+、K+,则此溶液中不可能存在的离子是
A.MnO![]() B.Fe3+ C.NO
B.Fe3+ C.NO![]() D.Cu2+
D.Cu2+
17.除去下列各组物质中混有的少量杂质(括号内为杂质)所用试剂不正确的是
A.Fe2O3(Al2O3)用NaOH溶液
B.乙酸乙酯(乙醇)用乙酸
C.铜粉(FeS)用稀H2SO4
D.CO2(SO2)用饱和NaHCO3溶液
18.结构简式是CH2==CHCHO的有机物不能发生的反应是
A.加成反应 B.银镜反应
C.氧化反应 D.水解反应
第Ⅱ卷(非选择题 共76分)
注意事项:
1.第Ⅱ卷共4页,用钢笔或圆珠笔直接答在试题卷上。
2.答卷前将密封线内的项目填写清楚。
| 题 号 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | 26 | 总 分 |
| 分 数 |
三、(本题包括2小题,共23分)
19.(12分)从固体物质A开始,可以发生如下框图所示的一系列变化:
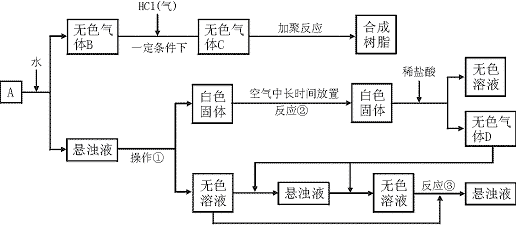
回答下列问题:
(1)在实验室中收集气体B的方法是 。
(2)操作①的名称是 ,操作中所使用的玻璃仪器的名称是 。
(3)反应②的化学方程式 ;反应③的化学方程式 。
(4)A的电子式 。
20.(11分)某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液时,选择甲基橙作指示剂,请填写下列空白:
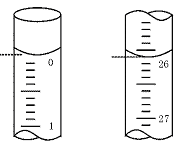
图8—1
(1)用标准的盐酸溶液滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视 。直到因加入一滴盐酸后,溶液由黄色变为橙色,并
为止。
(2)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是 。
A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液
B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
(3)若滴定开始和结束时,酸式滴定管中的液面如图8—1所示:
则起始读数为 mL,终点读数为 mL;所用盐酸溶液的体积为 mL。
(4)某学生根据三次实验分别记录有关数据如下表:
| 滴定次数 | 待测氢氧化钠溶液的体积/mL | 0.1000 mol/L酸的体积/mL | |||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | |||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 | |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 | |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 | |
请选用其中合理的数据列式计算该氢氧化钠溶液的物质的量浓度:
c(NaOH)= 。
四、(本题包括4小题,共39分)
21.(8分)请根据下图完成下列各题:
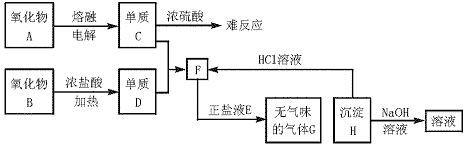
(1)请写出:
①氧化物B与浓盐酸反应的离子方程式 ;
②F溶液与E溶液反应的离子方程式 ;
③沉淀H与NaOH溶液反应的化学方程式 。
(2)单质C与浓H2SO4共存的现象称为 。
22.(12分)有A、B两容器,A容器容积固定,B容器容积可变。一定温度下,在A中加入2 mol N2、3 mol H2,当N2+3H2![]() 2NH3反应达平衡时生成的NH3的物质的量为m。
2NH3反应达平衡时生成的NH3的物质的量为m。
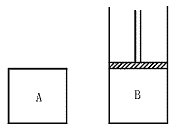
(1)相同温度下,在B中加入4 mol N2,6 mol H2。当反应达平衡时,B的压强与A的压强相等,B中生成的NH3的物质的量(填大于、等于或小于多少m,下同) ;当B的容积与A的容积相等,B中反应达平衡时,生成的NH3的物质的量 。
(2)相同温度下,在B容器中加入1 mol NH3,并保持B的容积为A的一半。要使B中反应达平衡时,各物质的质量分数与上述A容器中达平衡时相同,则起始时应加入 mol N2和 mol H2。
23.(11分)A、B、C、D、E五种短周期元素,已知:它们的原子序数依次增大,A、B两种元素的核电荷数之差等于它们的原子最外层电子数之和;B原子最外层电子数比其次外层电子数多2;在元素周期表中,C是E在不同周期邻族元素;D和E的原子序数之和为30,它们两两形成的化合物有甲、乙、丙、丁四种。这四种化合物中原子个数之比如下表:
| 甲 | 乙 | 丙 | 丁 | |
| 化合物中各元素原子个数比 | A∶C=1∶1 | B∶A=1∶2 | D∶E=1∶3 | B∶E=1∶4 |
(1)写出A—E的元素符号:A: ,B: ,C: ,D: ,E: 。
(2)向甲的水溶液中加入MnO2,氧化产物是 。
(3)已知有机物乙的分子为平面结构,碳氢键键角为120°,实验室制取乙的化学方程式为: 。
(4)丙的水溶液呈酸性,与饱和NaHCO3溶液反应会产生大量气体和难溶物,有关离子方程式是 。
24.(8分)有甲、乙两份等体积的浓度均为0.1 mol·L-1的氨水,pH=11。
(1)将甲用蒸馏水稀释100倍,由NH3·H2O的电离平衡向 (填“促进”或“抑制”)电离的方向移动,溶液的pH将变为 (填序号)
A.9~10之间 B.11 C.12~13之间 D.13
(2)将乙用0.1 mol·L-1的NH4Cl溶液稀释100倍,稀释后的乙溶液与稀释后的甲溶液比较,甲的pH 乙的pH值(填“大于”“小于”或“等于”),其原因是 。
五、(本题包括2小题,共14分)
25.(8分)NaOH和Ba(OH)2混合溶液的pH=14,取该溶液100 mL,持续通CO2,当溶液吸收的CO2的体积(标准状况)为0.560 L时生成沉淀最多。试通过计算回答(假设溶液体积不发生变化):
(1)NaOH和Ba(OH)2的物质的量浓度各是多少?
(2)当溶液吸收的CO2的总体积为2.24 L时,溶液中各离子(除H+、OH-)的物质的量浓度各是多少?
26.(6分)有机物A可以被还原成饱和一元醇,也可以被氧化为饱和一元羧酸,该一元醇和该一元羧酸在浓硫酸的作用下生成有机物B。取4.4 gB充分燃烧,使产物先与足量的无水氯化钙充分作用,无水氯化钙质量增加3.6 g,再与足量的碱石灰充分作用,碱石灰质量增加8.8 g,求A和B的结构简式。
 含 成
含 成