2003年MAM高考化学仿真试题(六)
MAM: M-March A-April M-May
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。第Ⅰ卷1至4页,第Ⅱ卷5至8页。共150分,考试时间120分钟。
第Ⅰ卷(选择题 共74分)
注意事项:
1.答第Ⅰ卷前,考生务必将自己的姓名、准考证号、考试科目、试卷类型(A、B)用铅笔涂写在答题卡上。
2.每小题选出答案后,用铅笔把答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其他答案标号。不能答在试卷上。
3.考试结束后,考生将本试卷和答题卡一并交回。
一、选择题(本题包括8小题,每小题3分,共24分;每小题只有一个选项符合题意)
1.下列变化中,一定不属于化学变化的是
A.燃烧 B.爆炸 C.红磷变成白磷 D.分馏
2.对于4NH3(g)+5O2(g)====4NO(g)+6H2O(g)的反应来说,以下化学反应速率的表示中,反应速率最快的是
A.v(NH3)=0.40 mol·L-1·s-1 B.v(O2)=0.48 mol·L-1·s-1
C.v(NO)=0.36mol·L-1·s-1 D.v(H2O)=0.55 mol·L-1·s-1
3.由2个C原子、1个O原子、1个N原子和若干个H原子组成的有机化合物,氢原子数最多为
A.5个 B.6个 C.7个 D.8个
4.实验室中由硫酸钠溶液制取纯净的硫酸钡,不需要的操作是
A.加入BaCl2溶液 B.过滤 C.洗涤 D.降温
5.下列说法中正确的是
A.在标准状况下,1 mol气体所占的体积叫做气体摩尔体积
B.只有在标准状况下,1 mol 气体所占的体积才约为22.4 L
C.在2 g由![]() H和
H和![]() O构成的水中,所含中子的物质的量为1 mol
O构成的水中,所含中子的物质的量为1 mol
D.当气体的物质的量与温度一定时,其体积与压强成正比
6.向1 L 1 mol·L-1的AlCl3溶液中加入若干氨水,结果得到39 g沉淀,则所加溶液中含NH3·H2O的物质的量可能为
A.0.5 mol B.1.5 mol C.3.5 mol D.3 mol
7.已知t℃时,某物质的溶液a g中含溶质m g,若该溶液蒸发b g水并恢复到t℃时,析出溶质m1 g;若原溶液蒸发c g水并恢复到t℃时,则析出溶质m2 g(析出的溶质均不含结晶水)。则在t℃时该物质的溶解度一定是
A.![]() g B.
g B.![]() g
g
C.![]() g D.
g D.![]() g
g
8.Na3N是离子化合物,它和水作用可产生NH3,下列说法正确的是
A.Na+和N3-的电子层结构都与氖原子相同
B.Na3N与盐酸反应只生成一种盐
C.Na+的半径大于N3-的半径
D.Na3N和水反应时,Na3N是还原剂
二、选择题(本题包括10小题,每小题5分,共50分;每小题有一个或两个选项符合题意)
9.已知某温度下,0.01 mol·L-1的NaHA溶液中,c(H+)>c(OH-),则下列关系式一定正确的是
A.溶液的pH=2 B.c(H+)·c(OH-)=10-14
C.c(Na+)=0.01 mol·L-1≥c(A2-) D.c(Na+)+c(H+)=c(HA-)+2c(A2-)+c(OH-)
10.在反应2X+5Y====4R+2M中,已知R和M的摩尔质量之比为22∶9,当2.6 g X与Y完全反应,生成4.4 g R,则在此反应中消耗Y和生成M的质量比为
A.26∶9 B.3∶1 C.40∶9 D.53∶9
11.下列关于蛋白质的叙述中正确的是
A.天然蛋白质都可水解生成氨基酸
B.生物催化剂“酶”是蛋白质,在高温时其活性强
C.蛋白质溶液中的蛋白质分子可透过半透膜
D.蛋白质变性后仍可再溶于水
12.在一定条件下,甲醇和等物质的量的氧气恰好能完全反应,其产物应是
A.CO2、H2O B.HCHO、H2O
C.HCOOH、H2O D.CO2、CO、H2O
13.用惰性电极电解2 L 1 mol·L-1的硫酸铜溶液,在电路中通过0.5 mol电子后,将电源反接,电路中又通过1 mol电子,此时溶液中c(H+)是(设溶液体积不变)
A.1.5 mol·L-1 B.0.75 mol·L-1
C.0.5 mol·L-1 D.0.25 mol·L-1
14.下列反应的离子方程式正确的是
A.氢氧化镁溶于醋酸:
Mg(OH)2+2H+====Mg2++2H2O
B. 1 L 0.01 mol·L-1的NaHCO3溶液与1 L 0.01 mol·L-1的Ba(OH)2溶液混合:
HCO![]() +OH-+Ba2+====BaCO3↓+H2O
+OH-+Ba2+====BaCO3↓+H2O
C.二氧化碳通入次氯酸钠溶液:
ClO-+CO2+H2O====CO![]() +HClO
+HClO
D.铝片放入氢氧化钠溶液中:
2Al+2OH-+2H2O====2AlO![]() +3H2↑
+3H2↑
15.将5.208 g纯铁粉溶于过量稀H2SO4中,在加热条件下,用2.525 g KNO3去氧化Fe2+,充分反应后溶液还呈较强的酸性,溶液中余下的Fe2+还需要0.009 mol Cl2才能被完全氧化,则KNO3的还原产物中氮元素的化合价为
A.-3 B.+4 C.+3 D.+2
16.冶炼金属有下列方法:①焦炭法,②水煤气法,③活泼金属置换法,④电解法。古代有(Ⅰ)火烧孔雀石[Cu2(OH)2CO3]炼铜,(Ⅱ)湿法炼铜;现有(Ⅲ)铝热法炼铬,(Ⅳ)从光卤石中炼镁。以下对它们的冶炼方法分析不正确的是
A.(Ⅰ)① B.(Ⅱ)② C.(Ⅲ)③ D.(Ⅳ)④
17.已知HIO既能和盐酸又能和氢氧化钠发生中和反应,则它与盐酸反应的产物是
A.IO- B.H2O C.HI D.ICl
18.现代建筑的门窗框架,常用电解加工成古铜色的硬铝制造。取硬铝样品进行如下实验(已知锰比铁活泼):
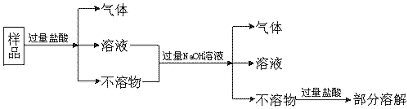
由此推知硬铝的组成是
A.Al、Mg、Si、Zn B.Al、Cu、Mg、Si、Mn
C.Al、Fe、C、Cu D.Al、Si、Zn、Na
第Ⅱ卷(非选择题 共76分)
注意事项:
1.第Ⅱ卷共4页,用钢笔或圆珠笔直接答在试题卷上。
2.答卷前将密封线内的项目填写清楚。
| 题 号 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | 总 分 |
| 分 数 |
19.(12分)下面a~f是中学化学实验中常用的几种仪器:
a.量筒 b容量瓶 c.圆底烧瓶 d.滴定管 e.温度计 f.托盘天平
(1)其中要标示出仪器具体使用温度的是 (填空编号)。
(2)可作反应容器并能进行加热的是 (填写编号)。
(3)由于下列错误操作,使得到的数据比正确操作所得数据偏小的是 (填写选项)。
A.记录量筒中液体的体积时,俯视液面读数
B.称取14.2 g NaCl固体时,将砝码放在左盘,NaCl固体放在右盘
C.用容量瓶配制一定物质的量浓度的NaOH溶液时,最后俯视刻度线加水至凹液面与刻度线相平
(4)有下列实验:①苯与溴的取代反应;②苯的硝化反应;③乙醛的银镜反应;④酚醛树脂的制取;⑤乙酸乙酯的制取
其中需要使用温度计的有 (填写编号)。
20.(12分)已知溴乙烷跟氰化钠反应后再水解可以得到丙酸,CH3CH2Br![]() CH3CH2CN
CH3CH2CN![]() H2OCH3CH2COOH,产物分子比原化合物分子
H2OCH3CH2COOH,产物分子比原化合物分子
多了一个碳原子,增长了碳链。请根据以下框图回答问题:
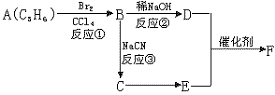
F分子中含有8个原子组成的环状结构
(1)反应①②③中属于取代反应的是 (填反应序号)。
(2)写出结构简式:E ,F 。
(3)写出C![]() E的化学方程式
。
E的化学方程式
。
四、(本题包括4小题,共42分)
21.(10分)已知:①A、B、C、D四种物质均含元素X,有的还可能含有元素Y、Z。元素Y、X、Z的原子序数依次增大;②X在A、B、C、D中都不呈现它的最高化合价;③室温下单质A与某种常见一元强碱溶液反应可得到B和C;④化合物D受热催化分解,可制得元素Y的单质。
(1)元素X是 ,Z是 。
(2)写出③中反应的化学方程式: 。
(3)写出④中反应的化学方程式: 。
22.(8分)硫酸铜晶体结晶水含量的测定实验:
(1)使用的主要仪器有:托盘天平(附砝码)、研钵、三脚架、 、 、
、 、 、 。
(2)根据实验数据计算硫酸铜晶体里结晶水的质量分数公式为:
w(结晶水)=![]() ×100%
×100%
某同学实验后得出数值为38.5%,与理论数值36%相比,测定结果偏高,试分析其实验操作中可能使结果偏高的主要原因(至少答两条)
① ,
② 。
23.(12分)过氧化氢(H2O2)俗名双氧水,医疗上可作外科消毒剂。
(1)H2O的电子式为 ,固态时H2O2为 晶体。
(2)将双氧水加入酸性KMnO4溶液,溶液的紫红色消褪了,此时双氧水表现出 性。
(3)向含酚酞的Na2CO3溶液中滴入双氧水,溶液由红色褪成无色,再向此溶液中加入足量的0.1 mol·L-1的NaOH溶液,始终不再显红色,这是因为双氧水有 性。
24.(12分)现通过实验来测定草木灰中钾的质量分数(钾元素在草木灰中以K2SO4、KCl、K2CO3形式存在)。实验步骤如下:
①称量a g样品,溶解、过滤。
②在滤液中滴加足量的Ba(NO3)2溶液,过滤,将沉淀干燥后称量,得到b g固体。
③将得到的b g固体全部放入足量的盐酸中充分搅拌、过滤,将不溶物干燥后称量,得到c g固体。
④在步骤②所得到的滤液中滴加足量的用硝酸酸化的AgNO3溶液,过滤,将沉淀干燥后称量,得到d g固体。
回答下列问题:
(1)用托盘天平称量一定量的草木灰样品,当样品的称量只需很少时,怎样加足样品量?
(2)在步骤②中怎样判断沉淀已经完全? ,若沉淀不完全,处理的办法是 。
(3)本实验中是否能用BaCl2代替Ba(NO3)2? 。其理由是 。
(4)假设草木灰中所含的可溶性盐都是钾盐,则本实验测得样品中含钾的质量分数是(列出算式,不需化简) 。
五、(本题包括1小题,共10分)
25.(10分)今有一硫酸和硝酸的混合溶液,取出10 mL,加入足量的BaCl2溶液,经过滤、洗涤、烘干得沉淀9.32 g,滤液与4 mol·L-1的苛性钠溶液反应,用去35 mL荷性钠溶液时恰好中和。求:
(1)原混合溶液中硝酸和硫酸的物质的量浓度。
(2)另取10 mL原溶液,加入3.2 g铜粉共热,生成标准状况下一氧化氮的体积(mL)是多少?