选择题训练(43)
一、选择题(每小题只有一个正确答案,每小题4分,8小题共32分)
1.生命起源的研究是世界性科技领域的一大课题,科学家模拟10亿年前的还原性大气环境进行紫外线辐射实验,认为生命起源的第一层次是产生了 ( )
A.氨基酸 B.蛋白质 C.羧酸 D.糖类
2.吸进人体内的氧有2%转化为氧化性极强的活性氧,这些活性氧能加速人体衰老,被称为“生命杀手”,中国科学家尝试用Na2SeO3清除人体内活性氧,则Na2SeO3的作用是( )
A.氧化剂 B.还原剂
C.既是氧化剂又是还原剂 D.既不是氧化剂又不是还原剂
3.下列物质性质的变化规律与分子间作用力有关的是( )
A.HF、HCl、HBr、HI的热稳定性依次减弱
B.金刚石的硬度大于硅,其熔、沸点也高于硅
C.NaF、NaCl、NaBr、NaI的熔点依次降低
D.F2、Cl2、Br2、I2的熔、沸点逐渐升高
4.毒品一直影响社会安定。吗啡与海洛因都是被严格查禁的毒品,已知吗啡的分子式是
C17H19NO3,海洛因是吗啡的二乙酸酯,则海洛因的分子式是 ( )
A.C21H23NO3 B.C21H22NO5 C.C21H23NO5 D.C21H27NO7
![]() 5.下列热化学方程式书写正确的是 ( )
5.下列热化学方程式书写正确的是 ( )
|
B.H2(g)+![]() O2(g)=H2O (1);ΔH=-285.8kJ/mol
O2(g)=H2O (1);ΔH=-285.8kJ/mol
C.2H2(g)+O2(g)=2H2O (1);ΔH =-571.6kJ
D.C(s)+O2(g)=CO2(g);ΔH= +393.5kJ/mol
6.有![]() 、Ym+、Zp—
3种短周期元素的离子,它们各自带有的电荷数p<n<m=3,且Zp—的电子层数比
、Ym+、Zp—
3种短周期元素的离子,它们各自带有的电荷数p<n<m=3,且Zp—的电子层数比![]() 、Ym+多1,比较X、Y、Z及其化合物,则下列说法正确的是 ( )
、Ym+多1,比较X、Y、Z及其化合物,则下列说法正确的是 ( )
A.它们的最高价氧化物的水化物之中,Y(OH)m是一种两性氢氧化物,其碱性比X(OH)n弱,
其酸性也比Z的最高价含氧酸弱
B.原子半径Z>X>Y
C.单质的熔点依Z、Y、X递增
D.气态氢化物稳定性依X、Y、Z增强
7.实验台上有下列仪器或用品:铁架台、铁圈、铁夹、三角架、石棉网、滤纸、烧杯、漏斗、分液漏斗、酒精灯、玻璃棒、量筒、蒸发皿、圆底烧瓶、火柴。只用上述仪器或用品,不能 进行的实验操作是 ( )
A.蒸发 B.萃取 C.过滤 D.蒸馏
8.所谓合金,就是不同种金属(也包括一些非金属)在熔化状态下形成的一种熔合物,根据下列四种金属的熔沸点:
| Na | Cu | Al | Fe | |
| 熔点 | 97.5℃ | 1083℃ | 660℃ | 1535℃ |
| 沸点 | 883℃ | 2595℃ | 2200℃ | 3000℃ |
其中不能形成合金的是 ( )
A.Cu和Na B.Fe与Cu C.Cu与Al D.Al与Na
二、选择题(每小题4分,10小题共40分,每小题有一个或两个正确选项。)
9.A和M为两种元素,已知A位于短周期,且A2—与M+的电子数之差为8,则下列说法中正确的是 ( )
A.A和M的原子序数之差为8 B.A和M原子的电子总数之和可能是11
C.A和M原子的最外层电子数之和为8 D.A和M原子的最外层电子数之差为7
10.向某无色透明溶液中加入铝粉,能放出氢气,则此溶液中可能大量共存的离子组是( )
A.HSO3—、Na+、OH—、K+ B.NO3—、OH—、Cl—、Ba2+
C.H+、Ba2+、Mg2+、NO3— D.Mg2+、Na+、Cl—、SO42—
11.能准确表示化学反应的离子方程式是 ( )
A.硝酸银与盐酸混合:Ag++HCl=AgCl↓+H+
B.碳酸氢铵与苛性钾溶液共热:NH4++OH—![]() NH3↑+H2O
NH3↑+H2O
C.碘化亚铁溶液中通入少量Cl2:Cl2+2I—=2Cl—+I2
D.过量的石灰水与磷酸二氢钾溶液反应:3Ca2++6OH—+3H2PO4—=Ca3(PO4)2↓+PO43—+6H2O
12.设NA表示阿伏加德罗常数,下列说法正确的是 ( )
A.一个氧原子的质量为ag,则氧元素的相对原子质量为aNA
B.在标准状况下,2g重氢气(D2)所含的分子数为NA
C.0.1molH218O2所含的中子数为2.0NA
D.1L1.5mol·L—1的AlCl3溶液中含Al3+数为1.5NA
13.在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数K(化学平衡常数可表示为K=c(CO)·c(H2O)/[
c(CO2)·c(H2)])和温度的关系如下表:
CO(g)+H2O(g),其化学平衡常数K(化学平衡常数可表示为K=c(CO)·c(H2O)/[
c(CO2)·c(H2)])和温度的关系如下表:
| t/℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
根据以上信息作出的下列判断中正确的是 ( )
A.此反应为吸热反应
B.此反应只有在达到平衡时,密闭容器中的压强才不再变化
C.此反应在1000℃达平衡时,c(CO2)·c(H2)/[c(CO)·c(H2O)]约为0.59
D.1100℃时,此反应的K值可能为0.9
14.从中草药茵陈蒿中可提取出一种利胆有效成分——对羟基苯乙酮,结构简式为: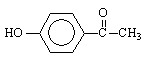 。这是一种值得进一步研究应用的药物。推测该药物不具有的化学性质是
。这是一种值得进一步研究应用的药物。推测该药物不具有的化学性质是
A.能跟氢氧化钠反应 B.能跟浓溴水反应
C.能跟碳酸氢钠反应 D.在催化剂存在时能被还原成含醇羟基的物质
15.下列物质中,在一定条件下,既能发生银镜反应,又能发生水解反应的是 ( )
A.葡萄糖 B.麦芽糖 C.溴乙酸 D.甲酸钠
16.用惰性电极电解1L足量KCl的溶液,若通过n mol电子的电量,则溶液的pH与n的关系是(设电解前后溶液的体积不变) ( )
A.pH=n B.pH=-lg n C.pH=14-lgn D.pH=lgn+14
17.pH和体积均相同的盐酸和醋酸(HAc)分别跟一定量的镁反应,当镁完全溶解时,放出的H2一样多,下列判断不正确的是 ( )
A.参加反应的酸质量相同
B.反应过程中逸出H2的平均速率v(HAc)> v(HCl)
C.开始时逸出H2的速率v(HAc)> v(HCl)
D.所需反应时间t(HCl)>t(HAc)
18.某温度下,mg某物质在足量O2中充分燃烧,其产物立即与过量的Na2O2反应,固体质量增
加mg,则在①H2,②CO,③CO和H2的混合气体,④HCHO,⑤CH3COOH,
⑥CH2—OH中符合题意的是 ( )
CH2—OH
A.均不符合 B.只有①②③ C.只有④⑤ D.全部符合