阳泉一中高考化学复习单元过关
《硫和硫的化合物 环境保护》试卷
(时间:50分钟。满分100分)
可能用到的原子量: H: 1 O: 16 N: 14 Na: 23 Cl: 35.5 C: 12 K: 39 Al:27
S: 32 Fe: 56 Mg: 24 Cu: 64
一、选择题(下列各题只有1-2个选项符合题意。每小题4分,共60分。请将答案填在答题卡上)
1、水体污染是一种严重的环境问题,下列那些措施可以减少水体污染
①控制工业生产中“废水”和城市污水排放;②减少有机农药的使用;③多植树造林;④减少SO2等气体的排放;⑤水生动植物的繁殖。
A、①②③④⑤ B、①②④ C、③④⑤ D、①②③
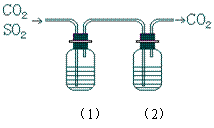 2、CO2气体中含少量SO2,欲得到干燥纯净的CO2,通过右图所示的洗气瓶,(1)(2)两瓶中所装的试剂应该是
2、CO2气体中含少量SO2,欲得到干燥纯净的CO2,通过右图所示的洗气瓶,(1)(2)两瓶中所装的试剂应该是
A (1)NaOH (2)浓H2SO4
B (1)浓H2SO4 (2)NaOH
C (1)NaHCO3 (2)浓H2SO4
D (1)浓H2SO4 (2)Na2CO3
3、下列物质均有漂白作用,其漂白原理相同的是
①过氧化钠 ②次氯酸 ③二氧化硫 ④活性炭 ⑤臭氧
A、①②⑤ B、①③⑤ C、②③④ D、①②③
4、下列设备在硫酸工业生产中用不上的是
A.沸腾炉、除尘器 B.接触室、热交换器
C.吸收塔 D.回转窑、氧化炉
5、关于浓硫酸的说法正确的是
A若洒在皮肤上应立即用纱布拭去浓硫酸,再用大量水冲洗。
B稀释时要将水沿器壁慢慢倒入浓硫酸中,并用玻璃棒不断搅拌。
C浓硫酸不分解、不挥发,所以能敞口放置在空气中。
D欲除去H2S气体中的水蒸气,可让混合气体通过盛有浓H2SO4的洗气瓶。
6、相同质量的四份铜片,分别置于足量的下列酸中,所得到的气体的物质的量最多的是
A 浓硫酸 B 稀硫酸 C 浓硝酸 D 稀硝酸
7、盛有氯化钡稀溶液甲乙两试管分别通入SO2至饱和,若向甲试管中加入足量硝酸,乙试管中加入足量氢氧化钠溶液,则下列叙述正确的是
A 甲、乙两试管都有白色沉淀生成 B 甲、乙两试管都没有白色沉淀生成
C 甲试管没有白色沉淀生成而乙试管有 D 甲试管有白色沉淀生成而乙试管没有
8、用接触法制5吨98%的浓硫酸,在理论上需要含FeS2 70%(杂质不含硫元素)的硫铁矿为
A、86t B、8.6t C、4.3t D、43t
9、下列反应中,调节反应物用量或浓度不会改变反应产物的是
A 硫化氢在氧气中燃烧 B 铁在硫蒸气中燃烧
C 二氧化硫通入石灰水 D 硫酸中加入锌粉
10.在2L的密闭容器中充入1molN2和3molH2,在一定条件下反应,2分钟后达到平衡,相同温度下测得平衡时混合气体的压强比反应前减少了![]() ,下列叙述正确的是
,下列叙述正确的是
A 平衡时混合气体中的N2、H2、NH3物质的量之比为1:3:2
B 2分钟内NH3的平均反应速率为0.2mol·L-1·min-1
C N2的转化率为20%
D 平衡时混合气体中的H2的体积百分含量为80%
11、将放射性的同位素35S与非放射性的Na2SO3溶液一起加热煮沸可得Na2S2O3。若将所制得的Na2S2O3酸化,又可得到含放射性硫的沉淀,而逸出的气体SO2无放射性。这表明
A.两种硫之间没有发生交换作用 B、在Na2S2O3内部两个硫原子等价
C.在Na2S2O3内部两个硫原子不等价 D、在合成Na2S2O3时,放射性硫作还原剂
12、将一定量的铁粉和硫粉的混合物共热,充分反应后冷却,再加入足量稀H2SO4,得到标准状况下气体11.2L,则原混合物可能的组成是(n代表物质的量)
A n(Fe)<n(S),总质量等于44g B n(Fe)>n(S),总质量等于44g
C n(Fe)=n(S),总质量大于44g D n(Fe)>n(S),总质量小于44g
13、下列各组溶液,不用其它试剂就可以将它们区别开的是
①KOH、K2CO3、MgSO4、KHSO4 ②NaNO3、HCl、NH4Cl、KOH
③BaCl2、CaCl2、Na2SO4、AgNO3 ④AlCl3、NaOH、NaHCO3、MgCl2
A.①④ B.①③ C.②④ D.②③
14、已知2.1gKOH和1.6g硫粉混合后加热,恰好完全反应:
aKOH+bS=cK2Sx+dK2S2O3+eH2O
则x值为:
A. 0 B. 1 C.2 D.3
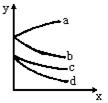 15、有等体积、等物质的量浓度的氢硫酸、亚硫酸溶液各两份,分别各通入C12、O2,溶液的pH(y)与通入气体的量(x)的关系如图所示。则a、b、c、d能正确代表pH变化的反应的是:
15、有等体积、等物质的量浓度的氢硫酸、亚硫酸溶液各两份,分别各通入C12、O2,溶液的pH(y)与通入气体的量(x)的关系如图所示。则a、b、c、d能正确代表pH变化的反应的是:
A.a为氢硫酸中通入O2 B.b为亚硫酸中通入O2
C.c为氢硫酸中通入Cl2 D.d为亚硫酸中通入Cl2
阳泉一中高考化学复习单元过关-《硫和硫的化合物 环境保护》
班级 姓名 成绩
选择题答题卡
| 1 |
| 2 |
| 3 |
| 4 |
| 5 |
| 6 |
| 7 |
| 8 |
|
| 9 |
| 10 |
| 11 |
| 12 |
| 13 |
| 14 |
| 15 |
|
| |
二、填空题(共21分)
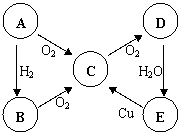 16、ABCDE五种物质中含有同一种元素,其相互转化
16、ABCDE五种物质中含有同一种元素,其相互转化
关系如右图所示。
(1) 如果A是淡黄色固体:(各1分)
则B是 E是 。
(以上均写化学式)
(2) 如果A是无色气体:(各2分)
B→C的化学方程式为 。
E→C的化学方程式为
17、有一混合气体可能由H2S、SO2、CO2、Cl2、HCl、H2中的几种组成,将此混合气体通人CuSO4溶液时生成黑色沉淀,另取混合气体通人少量澄清石灰水中,无沉淀产生;接着再通人Ba(OH)2溶液中有白色沉淀生成,该混合气体有一定含有 ;不含 ;可能含有 。(各2分)
18、某种由K2S和Al2S3组成的混合物中,这两种组成的物质的量之比为3:2。则含32克硫元素的这种混合物的质量为_____ _ 。已知液态SO2的密度为1.38g/cm3,则每个SO2分子的体积大约是 cm3。一定量SO2与NaOH溶液反应,所得溶液中含Na2SO3与NaHSO3之物质的量之比为3:5,则参加反应的SO2与NaOH物质的量之比为 。(各2分)
19、酸雨主要是燃烧含硫燃料时释放出SO2所造成的。现取一份雨水样品,每隔一定的时间测定其pH值,测定结果见附表:
附表:雨水样品pH值随时间的变化值
| 测试时间(h) | 0 | 1 | 2 | 4 | 8 |
| 雨水样品pH值 | 4.73 | 4.62 | 4.56 | 4.55 | 4.55 |
试说明雨水样品pH值减小的原因
。
三、实验题(共12分)
20、请用下列装置设计一个实验,以测定SO2转化为SO3的转化率:
|
|
|
|
|
|
|
|
|

|
|
|
|
|
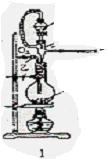

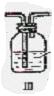

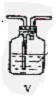
(1)这些装置的连接顺序(按气体从左到右的方向)是 → → → → → → → (填各接口的编号)。
(2)实验时甲仪器的作用与原理____________________________________________。
(3)从乙处均匀通入O2,为使SO2有较高的转化率,实验时Ⅰ处滴入浓硫酸与Ⅱ处加热催化剂的先后顺序是_________________ ___。
(4)Ⅳ处观察到的现象是____________________________。
(5)在Ⅰ处用大火加热烧瓶时,SO2的转化率会_______ _(填“增大”、“不变”或“减小”)。
(6)用n mol Na2SO3粉末与足量浓硫酸进行此实验,当反应结束时,继续通入O2一段时间,后,称得Ⅲ处增重mg,则本实验中SO2的转化率为______ ____ 。
四、计算题(共7分)
21、某空气污染监测仪是根据SO2与Br2的反应原理来测定空气中SO2含量。上述反应的溴来自一个装有酸性(H2SO4)KBr溶液的电解槽阳极上的氧化反应,电解槽的阳极室与阴极室是隔开的。当测量某地区空气中SO2含量时,空气(已除尘)以1.5×10-4m3/min的流速进入电解槽的阳极室,电流计显示电子通过的速率是8.56×10-11mol/s,此条件下能保持溴浓度恒定并恰好与SO2完全反应(空气中不含能与溴反应的其它物质)
(1) 写出监测过程中发生主要反应的化学方程式
(2) 计算该地区空气中SO2的含量(g/cm3空气)