08高考化学易错易漏选择题专题训练(五)
总分共64分 测试时间30分钟
 一、选择题(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意。)
一、选择题(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意。)
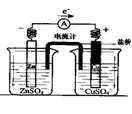
1.有关如右图所示原电池的叙述,正确的是(盐桥中装有含琼胶的KCl饱和溶液)
A.反应中,盐桥中的K+会移向CuSO4溶液
B.取出盐桥后,电流计依然发生偏转
C.铜片上有气泡逸出
D.反应前后铜片质量不改变
2.主链为4个碳原子的某烷烃有2种同分异构体,则相同碳原子数、主链也为4个碳原子的烯烃,其同分异构体有
A.3种 B.4种 C.5种 D.2种
3、应用纳米新材料能给人民币进行杀菌、消毒。我国纳米专家王雪平发明的“WXP复合纳米材料”的主要化学成份是氨基二氯代戊二醛的含硅衍生物,它能保持长期杀菌作用。有鉴于此,35位人大代表联名提交了一份议案,要求加快将此新技术应用到人民币制造中去。若戊二醛是直链的,请你根据所学的知识推断沸点不同的氨基二氯代戊二醛的同分异构体可能有
A、4种 B、5 种 C、6种 D、8种
4.设NA为阿伏加德罗常数,则下列说法正确的是
A.22.4 L乙烯中含有的分子数为NA
B.0.1 L 0.1 mol/L的CH3COOH溶液中含有的分子数为0.01 Na
C.含0.1 mol H2O2的水溶液跟Mn02充分作用,反应过程中转移的电子总数0.1Na
D.1 mol Si02晶体中含有2Na个Si一O键
5、下列离子方程式或化学方程式中正确的是BC
A、氯气通入水中 Cl2 + H2O = 2H+ + Cl— + ClO—
B、向Fe(OH)3中加入大量的氢溴酸:Fe(OH)3+3H+ = Fe3++3H2O
C、向Fe(NO3)2稀溶液中加入盐酸:3Fe2++4H++NO3- = 3Fe3++NO↑+2H2O
D、向NaHCO3溶液中加入过量的Ba(OH)2溶液: Ba2++2HCO3-+2OH-= BaCO3↓+CO32-+2H2O
5、下列各组离子能在指定溶液中,大量共存的是
①无色溶液中:K+,Cl—,Na+,H2PO4—,PO43—,SO42—
②使pH=11的溶液中:CO32—,Na+,AlO2—,NO3—,S2—,SO32—
③水电离的H+浓度c (H+)=10—12mol·L—1的溶液中:Cl—,HCO3—,NO3—,NH4+,S2O32—
④加入Mg能放出H2的溶液中:Mg2+,NH4+,Cl—,K+,SO42—
⑤使甲基橙变红的溶液中:Fe3+,MnO4—,NO3—,Na+,SO42—
⑥酸性溶液中:Fe2+,Al3+,NO3—,I—,Cl—,S2—
A ①②⑤ B ①③⑥ C ②④⑤ D ①②④
6.若某装置中发生如下反应:Cu+2H+=Cu2++H2↑,关于该装置的有关说法不正确的是
 A、该装置一定为原电池 B、该装置一定为电解池
A、该装置一定为原电池 B、该装置一定为电解池
C、金属铜为电解池的阳极 D、电解质溶液可能是硝酸溶液
7.在托盘天平的两盘中各放入同浓度同体积的足量稀硫酸,分别加入0.1mol两种金属,反应后需在游码中拔动0.2个大格后,天平才能恢复平衡。两金属是
A、镁和铝 B、铁和铝 C、镁和钠 D、铁和铜
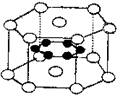
8、纳米材料的表面微粒数占微粒总数的比例极大,这是它有许多特殊性质的原因,假设某纳米颗粒中粒子分布类似于硼镁化合物,其结构如图所示,则这种纳米颗粒的表面微粒数占总微粒数的百分数为
A、22% B、70% C、66.7% D、33.3%
( 如右图○镁原子,位于定点和上下两个面心 ●硼原子,位于六棱柱的内部 )
二、选择题(本题包括8小题,每小题4分,共32分。每小题只有一个或两个选项符合题意。若正确答案包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该小题就0分。)
9、类推的思维方法在化学学习和研究中常会产生错误的结论,因此类推出的结论最终要经过实践的检验才能决定其正确与否。下列几种类推结论中不正确的是
A、Mg失火不能用CO2灭火;Na失火也不能用CO2灭火
B、Fe3O4可写成FeO·Fe2O3;Pb3O4也可写成PbO·pb2O3
C、不能用电解熔融AlCl3来制取金属铝;也不用电解熔融MgCl2来制取金属镁
D、Fe与S直接化合生成FeS;Al与S直接化合也可以得到Al2S3
10.臭氧分子的结构与SO2(极性分子)相似,可读做二氧化氧,在臭氧层中含量达0.2 ppm(ppm表示百万分之一)。臭氧是氧气吸收了太阳的波长小于242 nm的紫外线形成的,不过当波长在220 nm~320 nm的紫外线照射臭氧时,又会使其分解。下列说法中正确的是
A.打雷时也能产生臭氧,臭氧分子是直线型分子
B.臭氧转化为氧气和氧气转化为臭氧均须吸收能量
C.臭氧和氧气的相互转化能保持大气中臭氧的含量基本稳定
D.向大气中排放氮的氧化物和氟氯代烃均能加快臭氧的分解
11.下列反应必须用稀硫酸,而不能用浓硫酸的是
A.跟锌反应制氢气 B.跟苯、浓硝酸作用制硝基苯
C.溶解金属铜 D.作乙酸乙酯水解的催化剂
12.关于某无色溶液中所含离子的鉴别,下列判断正确的是
A.加入AgNO3溶液,生成白色沉淀,加稀盐酸沉淀不消失,可确定有Cl-存在
B.加入Ba(NO3)2溶液,生成白色沉淀,加稀盐酸沉淀不消失,可确定有SO42-存在
C.通入Cl2后,溶液变为黄色,加入淀粉溶液后溶液变蓝,可确定有I-存在
D.加入盐酸,生成的气体能使澄清石灰水变浑浊,则原溶液中一定有大量CO32-
13. 下列公式哪一个能用来精确地计算任意浓度c(HCl)的HCl水溶液中的氢离子浓度c(H+)(KW为水的离子积常数) ( )
A. c(H+)= c(HCl) B. c(H+)= c(HCl)+KW/ c(H+)
![]()
 C. c(H+)= c(HCl)+KW
D. c(H+)= c(HCl)-KW/ c(H+)
C. c(H+)= c(HCl)+KW
D. c(H+)= c(HCl)-KW/ c(H+)
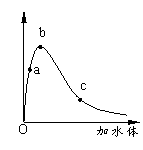
14.一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如右图所示,下列说法正确的是
A.a、b、c三点溶液的pH:c<a<b
B.a、b、c三点醋酸的电离程度:a<b<c
C.用湿润的pH试纸测量a处溶液的pH,测量结果偏小
D.a、b、c三点溶液用1mol/L氢氧化钠溶液中和,消耗氢氧化钠溶液体积:c<a<b
15.某单质能和浓硝酸反应,若参加反应的单质与硝酸的物质的量之比为1∶4,则组成该单质的元素在产物中的化合价可能是
A.+1 B.+2 C.+3 D.+4
16. 恒温恒压下,在容积可变的器皿中,反应2NO2(g)![]() N2O4(g)达到平衡后,再向容器内通入一定量NO2,又达到平衡时,N2O4的体积分数
N2O4(g)达到平衡后,再向容器内通入一定量NO2,又达到平衡时,N2O4的体积分数
A. 不变 B. 增大 C. 减少 D. 无法判断
参考答案:
1.B
2.B
3.D
4.C
5.C
6.A
7.A
8.B
9.BD
10.CD
11.AD
12.C
13.AB
14.BC
15.BD
16.A