高考热点专题测试卷:专题二 化学反应速率与化学平衡
说明:本试卷共分两卷,第Ⅰ卷为选择题,把正确答案序号填在题后答题卡内.第Ⅱ卷为非选择题,直接在本卷内作答.
第Ⅰ卷(共83分)
一、选择题:每小题3分,5小题共15分.每小题只有一个选项正确.把正确选项的代号填在题后答题卡中.
1.对于反应2A(g)+3B(g)=C(g)+5D(g),在某段时间内的平均反应速率为![]() ,(x代表某反应物或生成物)之间的关系,正确的是( )
,(x代表某反应物或生成物)之间的关系,正确的是( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
2.下列四种x的溶液,分别加入盛有![]() 盐酸的烧杯中,并加入水稀释至500mL,此时x和盐酸缓和地进行反应,其中反应速率最大的是( )
盐酸的烧杯中,并加入水稀释至500mL,此时x和盐酸缓和地进行反应,其中反应速率最大的是( )
A.20 mL,![]() B.20 mL,
B.20 mL,![]()
C.10 mL,![]() D.10 mL,
D.10 mL,![]()
3.对![]()
![]()
![]() 反应来说,以下反应速度的表示,最快的是( )
反应来说,以下反应速度的表示,最快的是( )
A.![]() B.
B.![]()
C.![]() D.无法判断
D.无法判断
4.在体积为V L的密闭容器进行如下反应:mA+nB![]() pC+qD用A物质表示的平均速率为
pC+qD用A物质表示的平均速率为![]() ,则t min时,D物质增加的物质的量为( )
,则t min时,D物质增加的物质的量为( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
5.四个试管中都装有![]()
![]() 溶液,分别在不同温度下加入
溶液,分别在不同温度下加入![]() 硫酸和一定量水,最先出现浑浊的是( )
硫酸和一定量水,最先出现浑浊的是( )
A.20℃,10 mL硫酸 B.20℃,5 mL硫酸,5 mL水
C.30℃,5 mL硫酸,2 mL水 D.30℃,4 mL硫酸,3 mL水
二、选择题:本题包括8小题,每小题4分,共32分.每小题有一个或二个选项符合题意.若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该题就为0分.把正确选项的代号填在题后答题卡中.
6.把![]() 放入一定量的蒸馏水中,一定温度下达到平衡:
放入一定量的蒸馏水中,一定温度下达到平衡:![]()
![]()
![]() .当向悬浊液中加入少量生石灰后,若温度保持不变,下列判断正确的是( )
.当向悬浊液中加入少量生石灰后,若温度保持不变,下列判断正确的是( )
A.溶液中![]() 数减少 B.[
数减少 B.[![]() ]增大
]增大
C.溶液pH不变 D.溶液pH增大
7.在一个固定体积的密闭容器中,保持一定温度,进行以下反应:![]()
![]()
![]() 已知加入
已知加入![]() 和
和![]() 时,达到平衡后生成a mol HBr.在相同条件下,起始时加入
时,达到平衡后生成a mol HBr.在相同条件下,起始时加入![]() 、
、![]() 、HBr的物质的量分别为x、y、z(均不为零),如果仍保持平衡时各组分的百分含量不变,以下推断不正确的是( )
、HBr的物质的量分别为x、y、z(均不为零),如果仍保持平衡时各组分的百分含量不变,以下推断不正确的是( )
A.x、y应满足的关系是y=2x
B.x、y、z应满足的关系是4x+z=2y
C.达平衡时HBr物质的量为![]()
D.达平衡时HBr物质的量一定仍为a mol
8.在一定条件下,将![]() 和
和![]() 充入一个容积固定的密闭容器中,发生反应
充入一个容积固定的密闭容器中,发生反应![]()
![]()
![]() .当反应达到平衡时
.当反应达到平衡时![]() 为n mol.在与上述完全相同的容器中,保持温度不变,若平衡时
为n mol.在与上述完全相同的容器中,保持温度不变,若平衡时![]() 仍为n mol,则下列组合中不正确的是( )
仍为n mol,则下列组合中不正确的是( )
| 起始状态/mol | ||
|
|
|
|
| A.2 | 0 | 2 |
| B.2.5 | 1.5 | 1 |
| C. | 2 |
|
| D.0 | 0 | 2 |
9.某固定体积的密闭容器中存在化学平衡:![]()
![]()
![]() ,在温度不变的条件下,再充入一定量的A物质,重新达到平衡时,下列判断中正确的是( )
,在温度不变的条件下,再充入一定量的A物质,重新达到平衡时,下列判断中正确的是( )
A.若a=b+c时,B的物质的量分数变大
B.若a=b+c时,B的物质的量分数不变
C.若a>b+c时,A的转化率不变
D.若a<b+c时,A的转化率变小
10.在容积不变的密闭容器中,在一定条件下发生反应:2A![]() B(g)+C(s),达到化学平衡后,升高温度,容器内气体的密度增大,则下列叙述正确的是( )
B(g)+C(s),达到化学平衡后,升高温度,容器内气体的密度增大,则下列叙述正确的是( )
A.若正反应是吸热反应,则A为非气态
B.若正反应是放热反应,则A为气态
C.在平衡体系中加入少量C,该平衡向逆反应方向移动
D.改变压强对该平衡的移动无影响
11.已建立化学平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,下列有关叙述正确的是( )
①生成物的百分含量一定增加 ②生成物的产量一定增加
③反应物的转化率一定增大 ④反应物浓度一定降低
⑤正反应速率一定大于逆反应速率 ⑥使用了合适催化剂
A.①② B.②⑤ C.③⑤ D.④⑥
12.将一定量的固体![]() 置于容积不变的密闭容器中(装有少量
置于容积不变的密闭容器中(装有少量![]() ),某温度下发生反应:
),某温度下发生反应:![]()
![]()
![]() ,
,![]()
![]()
![]() ,反应经过10 min达到平衡,测得
,反应经过10 min达到平衡,测得![]() ,
,![]() ,则下列叙述中不正确的是( )
,则下列叙述中不正确的是( )
A.容器里气体的密度为![]()
B.![]() 的分解率为20%
的分解率为20%
C.在这10 min内的平均反应速率![]()
D.化学反应速率![]()
13.甲萘醌(维生素K)有止血作用,它可用2-甲基萘氧化而制得,反应中常用乙酸作催化剂,该反应放热,可表示为:
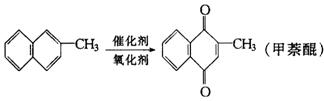
在某次合成反应中,用1.4 g(0.01 mol)的2-甲基萘,才制得0.17 g(0.001 mol)甲萘醌,已知该次合成反应的速率是快的,试判断产率低的原因是( )
A.使用了过量的氧化剂
B.把反应混合物加热
C.没有用乙酸作催化剂而改用其他催化剂
D.所生成的甲萘醌为沉淀物
三、选择题:本题包括9个小题,每小题4分,共36分.每小题只有一个选项符合题意.把正确选项的代号填在题后答题卡中.
14.已知工业上真空炼铷的原理如下:![]() ,对于此反应的进行能给予正确解释的是( )
,对于此反应的进行能给予正确解释的是( )
A.铷的金属活动性不如镁强,故镁可置换铷
B.铷的沸点比镁低,把铷蒸气抽出时,平衡右移
C.![]() 的热稳定性不如RbCl强
的热稳定性不如RbCl强
D.铷的单质状态较化合态更稳定
15.在一定条件下,反应![]()
![]()
![]() 的反应时间与生成物AB的质量分数(AB%)的关系如图所示,其中a为500℃,b为300℃时的情况(其他条件不变),c则为在时刻
的反应时间与生成物AB的质量分数(AB%)的关系如图所示,其中a为500℃,b为300℃时的情况(其他条件不变),c则为在时刻![]() 开始缩小容器容积(温度维持300℃)的情况,则Q的值应为( )
开始缩小容器容积(温度维持300℃)的情况,则Q的值应为( )

A.Q>0 B.Q<0 C.Q=0 D.无法判断
16.反应mA(g)+nB(g)![]() pC(g)+qD(g)经10 min后达到平衡,测得此时A的浓度减少了
pC(g)+qD(g)经10 min后达到平衡,测得此时A的浓度减少了![]() ,C的浓度增加了
,C的浓度增加了![]() ,又知,平均反应速率
,又知,平均反应速率![]() .达到平衡后,若保持温度不变,缩小容器体积,A的转化率不变,那么该反应的化学方程式应为( )
.达到平衡后,若保持温度不变,缩小容器体积,A的转化率不变,那么该反应的化学方程式应为( )
A.2A(g)+6B(g)![]() 3C(g)+5D(g)
3C(g)+5D(g)
B.3A(g)+B(g)![]() 2C(g)+2D(g)
2C(g)+2D(g)
C.3A(g)+B(g)![]() 2C(g)+D(g)
2C(g)+D(g)
D.A(g)+3B(g)![]() 3C(g)+3D(g)
3C(g)+3D(g)
17.在一真空密闭的定容容器中放入![]() 晶体并使之气化,当反应
晶体并使之气化,当反应![]()
![]()
![]() 建立平衡后,再通入一些
建立平衡后,再通入一些![]() 气体(温度不变),待反应再次达到新的平衡.则平衡混合气体中
气体(温度不变),待反应再次达到新的平衡.则平衡混合气体中![]() 的比值.新平衡与旧平衡相比( )
的比值.新平衡与旧平衡相比( )
A.新平衡时大 B.新平衡时小 C.不变 D.无法确定
18.把![]() 跟
跟![]() 混合于密闭容器中,在适当条件下,反应达到平衡时生成
混合于密闭容器中,在适当条件下,反应达到平衡时生成![]() ,若将所得平衡混合气体完全燃烧生成
,若将所得平衡混合气体完全燃烧生成![]() 和
和![]() ,需
,需![]() ( )
( )
A.(3a+b)mol B.![]()
C.![]() D.
D.![]()
19.在10 L密闭容器中,1 mol A和3 mol B在一定条件下反应:A(气)+xB(气)![]() 2C(气),2min后反应达到平衡时,测得混合气体共3.4 mol,生成0.4 mol C,则下列计算结果不正确的是( )
2C(气),2min后反应达到平衡时,测得混合气体共3.4 mol,生成0.4 mol C,则下列计算结果不正确的是( )
A.平衡时,物质的量比A∶B∶C=2∶11∶4
B.x值等于4
C.A的转化率20%
D.B的平均反应速率为![]()
20.从下列事实,找出不能用勒沙特列原理解释的是( )
A.在溴水中存在如下平衡:![]() ,当加入NaOH溶液后颜色变浅
,当加入NaOH溶液后颜色变浅
B.对![]()
![]()
![]() 平衡体系增加压强使颜色变深
平衡体系增加压强使颜色变深
C.反应![]()
![]()
![]() 升高温度使平衡向逆方向移动
升高温度使平衡向逆方向移动
D.合成氨反应:![]()
![]()
![]() ,为使氨的产率提高,理论上应采取低温高压的措施
,为使氨的产率提高,理论上应采取低温高压的措施
21.有A、B、C三种气体,若起始时取1 mol A与2 mol B,发生反应A+2B![]() 2C.达到平衡时[A]、[B]、[C]之比与反应速率
2C.达到平衡时[A]、[B]、[C]之比与反应速率![]() 、
、![]() 、
、![]() 之比恰好相同,则A的平衡转化率为( )
之比恰好相同,则A的平衡转化率为( )
A.30% B.40% C.50% D.66.7%
22.有mA(g)+nB(g)![]() pC(g)+qD(g)反应,经10 min达到平衡,结果A的浓度减少了
pC(g)+qD(g)反应,经10 min达到平衡,结果A的浓度减少了![]() ,B的浓度减少了
,B的浓度减少了![]() ,C的浓度增加了
,C的浓度增加了![]() ,然后增大容器容积,A、B、C的体积分数不变,则m∶n∶p∶q为( )
,然后增大容器容积,A、B、C的体积分数不变,则m∶n∶p∶q为( )
A.1∶3∶2∶2 B.2∶3∶3∶2
C.1∶3∶2∶1 D.3∶1∶2∶2
答题卡
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 |
| 分值 | 3分 | 3分 | 3分 | 3分 | 3分 | 4分 | 4分 | 4分 | 4分 | 4分 | 4分 |
| 选项 | |||||||||||
| 题号 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 |
| 分值 | 4分 | 4分 | 4分 | 4分 | 4分 | 4分 | 4分 | 4分 | 4分 | 4分 | 4分 |
| 选项 |
第Ⅱ卷(共67分)
四、本题包括2小题,共17分
23.(8分)如图所示,温度不变时某容器分隔A、B两部分,A容积固定不变,B有可移动的活塞,现有A中充入![]() 和
和![]() ,在B中充入
,在B中充入![]() 和
和![]() ,在相同条件下发生可逆反应:
,在相同条件下发生可逆反应:![]()
![]()
![]() .
.
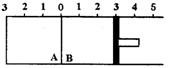
根据下列要求填写空白:
(1)若固定活塞位置在右侧的3处不动,达到平衡时,设A中压强为![]() ,B中压强为
,B中压强为![]() ,则
,则![]() 与
与![]() 的关系是
的关系是![]() _________
_________![]() (填“大于”、“小于”或“等于”).
(填“大于”、“小于”或“等于”).
(2)若要使A中与B中平衡状态相同,可移动活塞的位置应在________处.
(3)若活塞右移到5处,达到平衡后,B中![]() 为x mol,A中
为x mol,A中![]() 为y mol,则x和y的关系是y________x(填“大于”、“小于”或“等于”),理由是________________
为y mol,则x和y的关系是y________x(填“大于”、“小于”或“等于”),理由是________________
_____________________.
24.(9分)在温度为830 K时,下列可逆反应及其平衡具有某些特殊性![]()
![]()
![]() ,若起始浓度[CO]为
,若起始浓度[CO]为![]() 、[
、[![]() ]为
]为![]() ,反应达平衡时,
,反应达平衡时,![]() ;如果[CO]不变而将
;如果[CO]不变而将![]() 的起始浓度加大到
的起始浓度加大到![]() .则平衡时
.则平衡时![]() .请注意上述有关数据,总结出其中的规律,根据此规律,填写以下空白:
.请注意上述有关数据,总结出其中的规律,根据此规律,填写以下空白:
设830 K时,起始浓度[CO]为![]() ,[
,[![]() ]为
]为![]() ,反应达平衡时[
,反应达平衡时[![]() ]为
]为![]()
①当b不变,a减小,重新达平衡时,CO的转化率________,![]() 的转化率________(均填“提高”、“降低”或“不变”)
的转化率________(均填“提高”、“降低”或“不变”)
②当a=5,![]() 时,b=________;
时,b=________;
③当a=b时,![]() ________;
________;
④当b=4,c=2时,a= _________.
⑤用以表示a、b、c之间关系的代数式为:_________.
五、本题包括2小题,共17分
25.(8分)工业上用氨和二氧化碳反应合成尿素.已知下列物质在一定条件下均能与水反应产生![]() 和
和![]() .
.![]() 是合成氨的原料,
是合成氨的原料,![]() 供合成尿素用.若从充分利用原料的角度考虑,选用________(填序号)物质作原料较好.
供合成尿素用.若从充分利用原料的角度考虑,选用________(填序号)物质作原料较好.
A.CO B.石脑油(![]() 、
、![]() )
)
C.![]() D.焦炭
D.焦炭
(2)![]() 水解生成BiOCl沉淀.试回答下列问题:
水解生成BiOCl沉淀.试回答下列问题:
①![]() 分解的反应方程式为____________________________________.
分解的反应方程式为____________________________________.
②医药上把BiOCl叫做交氯酸铋,分析这种名称是否合理:_______________.
③把适量的![]() 溶于浓NaCl溶液中或溶于含有少量盐酸的水中都得到澄清溶液,试用平衡移动原理分析可能的原因____________________________________.
溶于浓NaCl溶液中或溶于含有少量盐酸的水中都得到澄清溶液,试用平衡移动原理分析可能的原因____________________________________.
26.(9分)等物质的量A、B、C、D四种物质混合,发生如下反应:
aA(?)+bB(?)![]() cC(固)+dD(?)
cC(固)+dD(?)
当反应进行到一定时间后,测得A减少n mol,B减少![]() ,C增加
,C增加![]() ,D增加n mol,此时达到化学平衡状态.
,D增加n mol,此时达到化学平衡状态.
(1)该化学方程式中各系数为a=________,b=________,c=________,d=________.
(2)若只改变压强,反应速率发生变化,但平衡不发生移动,则该反应中各物质的聚集状态是:A_________,B_________,D_________.
(3)若只升高温度,反应一段时间后,测知四种物质的量又达到相等,则该反应是_
_______反应(填“放热”或“吸热”)
六、本题共2小题,共17分
27.(9分)(1)在实验室中作小型实验:把物质A、B按一定比例充入一个表面积为![]() 的圆柱形容器,使压强为P,然后将整个体系用加热器加热到280℃,发生如下反应
的圆柱形容器,使压强为P,然后将整个体系用加热器加热到280℃,发生如下反应![]() ,若平均每分钟生成0.5 mol的C,容器表面向外散热速率平均为
,若平均每分钟生成0.5 mol的C,容器表面向外散热速率平均为![]() 为了维持恒温280℃,平均每分钟需用加热器向容器提供多少kJ的热量.(简述推理过程)
为了维持恒温280℃,平均每分钟需用加热器向容器提供多少kJ的热量.(简述推理过程)
答:_________________________________________.
(2)若将(1)的小型实验扩大为工业生产:将反应容器的底面半径和高度都扩大到原容器的10倍,做成“相似体”,并向其中将A、B按原比例充入,使压强仍为P,然后加热到280℃使反应开始.为了维持恒温280℃,反应开始后,应继续加热还是进行冷却?(设容器表面散热速率不变)
平均每分钟用加热器向体系提供或者用冷却器吸收了多少kJ的热量.(简述推理过程)
答:________________________________________.
(3)在恒温、恒压下,向(2)的“相似体”平衡体系中将A、B按原比例充入,重新达到平衡时,C的体积分数_________.
28.(8分)经过长期实践,人们总结出反应速率和反应物浓度间定量关系:在恒温下,对简单反应来说,化学反应速率同反应物浓度方次乘积成正比(反应物浓度的方次,等于反应式中各分子式前的计量数).如对于反应式mA+nB=C反应,![]() ,其中k为常数.
,其中k为常数.
今有一反应aA+bB=C,在25℃时,将A、B溶液按不同浓度混合,得下列实验数据:
| A的浓度( | B的浓度( | 反应速率( |
| 1.0 | 1.0 | 1.2×10-2 |
| 1.0 | 4.0 | 1.92×10-2 |
| 4.0 | 1.0 | 4.8×10-2 |
分析以上数据,求出a、b的值.
七、本题包括2小题,共15分
29.(6分)将![]() 和
和![]() 在适宜条件下按下式进行反应
在适宜条件下按下式进行反应![]()
![]()
![]() ,当在某一温度下达到化学平衡状态,试解答:
,当在某一温度下达到化学平衡状态,试解答:
(1)若测得平衡混合气体对空气的相对密度为0.6时,求![]() 的转化率.
的转化率.
(2)若测得平衡混合气体对空气的相对密度为0.47时,求![]() 在平衡混合气体中体积分数.
在平衡混合气体中体积分数.
30.(9分)下图装置中,容器甲内充入0.1 mol NO气体,干燥管内装有一定量![]() ,从A处缓慢通入
,从A处缓慢通入![]() 气体.恒温下,容器甲中活塞缓慢由B向左移动,当移至C处时容器体积缩小至最小,为原体积的
气体.恒温下,容器甲中活塞缓慢由B向左移动,当移至C处时容器体积缩小至最小,为原体积的![]() ,随着
,随着![]() 的继续通入,活塞又逐渐向右移动.
的继续通入,活塞又逐渐向右移动.
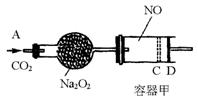
(1)①已知当活塞移至C处时,干燥管中物质的质量增加了2.24 g.此时,通入标准状况下的![]() 气体多少L?容器甲中
气体多少L?容器甲中![]() 转化为
转化为![]() 的转化率是多少?
的转化率是多少?
②活塞移至C处后,继续通入![]() ,此时活塞恰好回至B处.则a值必小于0.01,其理由是________.
,此时活塞恰好回至B处.则a值必小于0.01,其理由是________.
(2)若改变干燥管中![]() 的量,要通过调节甲容器的温度及通入
的量,要通过调节甲容器的温度及通入![]() 的量,使活塞发生从B到C,又从C到B的移动,则
的量,使活塞发生从B到C,又从C到B的移动,则![]() 的质量最小值应大于________g.
的质量最小值应大于________g.
参考答案
1.D 2.A 3.A 4.C 5.C 6.AC 7.D 8.D 9.BD 10.AB 11.B
12.D 13.B 14.B 15.A 16.B 17.B 18.B 19.A 20.B 21.C 22.D
23.(1)< (2)右侧的3处
(3)< B相当于减压了,减压后平衡向![]() 分解的方向移动,使B中
分解的方向移动,使B中![]() 的量减少了.
的量减少了.
24.①提高,降低;②b=4;③![]() ;④
;④![]() 或
或![]() 或ac+bc=ab
或ac+bc=ab
25.(1)B.根据反应:![]()
![]()
![]() ,
,![]()
![]()
![]() ,若要充分利用原料,显然要求原料与
,若要充分利用原料,显然要求原料与![]() 反应产生的
反应产生的![]() 和
和![]() 物质的量之比等于或接近于3∶1,上述反应趋于恰好反应,原料得以充分利用.
物质的量之比等于或接近于3∶1,上述反应趋于恰好反应,原料得以充分利用.
![]()
![]()
![]()
![]()
(2)①![]()
![]()
![]() ②不合理.因为BiOCl中,Cl的化合价为-1价.③浓NaOH溶液中,
②不合理.因为BiOCl中,Cl的化合价为-1价.③浓NaOH溶液中,![]() 抑制
抑制![]() 的溶解,使
的溶解,使![]() 的浓度减小,盐酸中
的浓度减小,盐酸中![]() 抑制
抑制![]() 的水解.
的水解.
26.(1)2、1、3、2 (2)A为气态,B为固态或气态,D为气态 (3)放热
27.(1)按1分钟计,生成0.5 mol
C产生热量45 kJ,而容器散热![]()
![]() ,所以应用加热器每分钟提供热量120 kJ-45 kJ=75 kJ
,所以应用加热器每分钟提供热量120 kJ-45 kJ=75 kJ
(2)容器半径和高度都变为原来10倍,则表面变为原来1000倍,平均每分钟生成C为0.5 mol×1000=500 mol,放出热量45000kJ,而容器散热12000 kJ,所以冷却器每分钟吸收热量45000 kJ-12000 kJ=33000 kJ
(3)不变
28.a=1 b=2
29.(1)![]() (2)1/10500 (3)10
(2)1/10500 (3)10
30.①39% ②12.5%
31.(1)①![]() 体积1.792 L;25%
体积1.792 L;25%
②当活塞由C向B移动时,因体积扩大使平衡:![]()
![]()
![]() 向体积扩大方向移动以至混合气体物质的量增大.增大的物质的量可由下式求出
向体积扩大方向移动以至混合气体物质的量增大.增大的物质的量可由下式求出
![]()
![]()
![]()
起始:0.08 mol 0
平衡:![]()
![]()
因平衡时混合气体总的物质的量为0.07 mol,由于活塞由C移至B,体积扩大,故![]() ,可知充入
,可知充入![]() 物质的量必小于0.01 mol
物质的量必小于0.01 mol
(2)1.56 g