2001北京市著名重点中学高考模拟试卷精选化学(第一模拟)
第Ⅰ卷 (选择题共83分)
一、选择题(本题包括5小题,每小题3分,共15分。每小题只有一个选项符合题意)
1.近年来,建筑装璜装饰材料进入家庭,调查发现经过装修的居室中由装璜装饰材料缓慢释放出来的化学污染物浓度过高,影响健康。这些污染物中最常见的是 [ ]
A.CO
B.SO2
C.甲醛、甲苯等有机物蒸汽
D.臭氧
2.国庆50周年庆典结束时,数万只小气球腾空而起,若从安全角度考虑,气球中不应充H2,而适宜用下列气体中的 [ ]
A.N2
B.He
C.CH4
D.空气
3.将磷矿石加工成过磷酸钙的目的是 [ ]
A.增加磷的含量
B.使它的性质稳定,便于运输
C.有利于改良土壤
D.使它转化为较易溶于水的物质
4.下列反应中,水作还原剂的是 [ ]
A.2Na+2H2O=2NaOH+H2↑
B.Cl2+H2O=HCl+HClO
C.2F2+2H2O=4HF+O2
D.SO2+H2O=H2SO3
5.据报道,1995年化学家合成了一种化学式为C200H200含多个—C≡C—的链烃,则分子中含碳碳叁键最多是 [ ]
A.49个
B.50个
C.51个
D.不能确定
二、选择题(本题包括8小题,每小题4分,共32分,每小题有一个或两个选择符合题意。若正确答案只包括一个选项,多选时,该题为0分,若正确答案包括两个选项,只选一个是正确的给2分,选两个且都正确的给4分,但只要选错一个,该小题就为0分)
6.同种元素的不同微粒,它们的 [ ]
A.质量数一定相同
B.核外电子数一定相同
C.电子层数可能不同
D.原子量一定相同
7.某种混合气体,可能含有N2、HCl、CO。把混合气体依次通过足量的NaHCO3溶液和灼热CuO,气体体积都没有变化。再通过足量的NaO2固体,气体体积减小。最后通过灼热的铜网,经充分反应后气体体积又减小,但还有剩余气体。以下对混合气体组成的判断,正确的是 [ ]
A.一定没有N2;CO和HCl中至少有一种
B.一定有N2、HCl和CO
C.一定有N2;CO和HCl中至少有一种
D.一定有N2和HCl;没有CO
8.下列各组物质中,只用水就可以鉴别的是 [ ]
①固体:NaCl、NaOH、NH4NO3②气体:H2、O2、SO2③液体:苯、酒精、四氯化碳④固体:Ba(NO3)2、KCl、Na2SO4
A.只有③
B.只有④
C.①和③
D.②和④
9.下列物质中含有离子键和非极性共价键的是 [ ]
A.Na2O2
B.Na2SO4
C.CCl4
D.C2H4
10.有两种溶液,pH分别为3和5,这两种溶液的[H+]之比是
[ ]
A.3∶5
B.5∶3
C.100∶1
D.1∶100
11.X元素的阳离子和Y元素的阴离子具有与氩原子相同的电子层结构,下列叙述正确的是 [ ]
A.X的原子序数比Y的小
B.X原子的最外层电子数比Y的大
C.X的原子半径比Y的大
D.X元素的最高价正价比Y的小
12.下列离子方程式中,正确的是 [ ]
A.氨气通入醋酸溶液中CH2COOH+NH3=CH3COONH4
B.澄清的石灰水跟盐酸反应H++OH-=H2O
C.碳酸钡溶于醋酸BaCO3+2H+=Ba2++H2O+CO2↑
D.金属钠跟水反应2Na+2H2O=2Na++2OH-+H2↑
13.在固定体积的密闭容器中,一定温度下,加入2 molBr2,1molH2,发生反应:
Br2(气)+H2(气)
![]() 2HBr
2HBr
达到平衡时,HBr的质量分数为W%。在相同的条件下,按下列情况充入物质,达到平衡时,HBr的质量分数仍为W%的是 [ ]
A.2molHBr
B.3molHBr
C.4molBr2+2 molH2
D. 1mol Br2+2 mol HBr
三、选择题(本题包括9小题,每小题4分,共36分,每小题只有一个选项符合题意)
14.质量数为86,有49个中子的原子R,可形成的离子是
[ ]
A.R2-
B.R-
C.R+
D.R2+
15.A,B为主族元素中的两种,元素A的阳离子与元素B的阴离子具有相同的电子层结构,以下关于A,B元素性质的比较中,正确的是 [ ]
①原子半径A<B②原子序数A>B③原子最外层电子数B>A④元素所在的周期数A>B⑤A的最高正价与B的最低负价的绝对值相等
A.②③④
B.①②
C.④⑤
D.②⑤
![]()

[ ]
A.①②
B.①③
C.③④
D.②④
17.下列关于Fe(OH)3胶体的说法不正确的是 [ ]
A.Fe(OH)3溶液与硅酸溶胶混合将产生凝聚现象
B.Fe(OH)3胶体粒子在电场影响下将向阳极移动
C.Fe(OH)3胶体微粒不停地作布朗运动
D.光线通过Fe(OH)3溶胶时会发生丁达尔现象
18.用铂电极电解CuSO4溶液,当溶液中Cu2+浓度降至一定范围时,需加入适量的物质。如果要使加入物质后溶液的浓度和体积恢复到电解前的状况,所加入的物质是 [ ]
A.CuSO4
B.CuSO4·5H2O
C.CuO
D.Cu(OH)2
19.某饱和一元醛发生银镜反应时,生成了21.6g银,将等质量的该醛完全燃烧可生成26.4gCO2,则该醛为 [ ]
A.丙醛
B.丁醛
C.己醛
D.乙醛
![]()
水中含离子浓度最小的是 [ ]
A.蒸馏
B.加热煮沸
C.加Ca(OH)2与Na2CO3
D.离子交换法
21.24mL 0.05 mol/L的Na2SO3溶液,恰好与20mL 0.02 mol/L的K2Cr2O7溶液完全反应,则Cr在还原产物中的化合价是 [ ]
A.+6
B.+3
C.+2
D.0
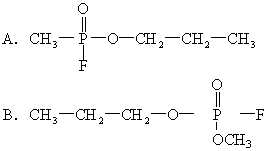
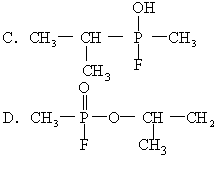
22.1995年3月20日在日本东京地铁发生了震惊世界的“沙林”毒气袭击事件,造成11人死亡,5500多人受伤。恐怖分子使用的“沙林”是剧毒的神经毒剂,其化学名称为甲氟磷酸异丙酯。已知甲氟磷酸
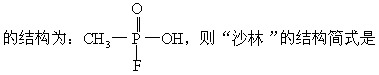
[ ]
第Ⅱ卷 (非选择题共67分)
四、(本题包括2小题,共20分)
23.(6分)用滴管将新制的饱和氯水逐滴滴入酚酞的氢氧化钠稀溶液(样品)中,当滴到最后一滴时,红色突然褪去,产生该现象的原因可能有两个:
①是由于____(简要文字说明)
②是由于____(简要文字说明)
简述怎样用实验证明红色褪去的原因是①或者是②。
24.(14分)用下图(Ⅰ)装置加入稀硝酸和铜片,在实验室里制备NO,在烧瓶中实际见到的气体是____色的,这就使人怀疑稀硝酸与铜反应是否真能生成NO。即使可用排水制气法收集到NO,也可以认为NO2与水反应生成了NO而无法证实,现用U形管、分液漏斗、酒精灯、胶塞等仪器,设计下图(Ⅱ)装置,来证实稀硝酸与铜反应的确生成了NO而不是NO2。
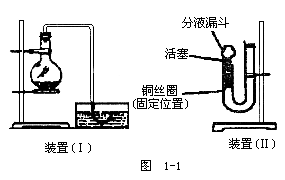
(1)补充完成实验步骤:
a.检验装置的气密性。
b.将活塞打开,从U形管长管口注入稀硝酸,一直注到____为止。
c.关闭活塞,用酒精灯在____加热,当观察到____时,立即撤去酒精灯。
(2)观察实验现象(Ⅰ)可以在何处观察到无色的NO气体?____反应在什么情况下可以自动停止?
(铜丝与稀HNO3均未反应完)____。(Ⅱ)如果再将活塞慢慢打开,可立即观察到的明显现象有____。通过以上两个过程可以获得NO与NO2鲜明对照的实验效果。
(3)若用装置(Ⅱ)制取并收集NO,应对装置作何简单的改动。
_______________。
五、(本题包括2小题,共17分)
25.(9分)物质A是一种高熔点化合物,不溶于硫酸和硝酸,却溶于氢氟酸;C是一种气体,D是白色胶状沉淀,E是白色固体。A、B、C、D、E间转化关系如力1-2所示:
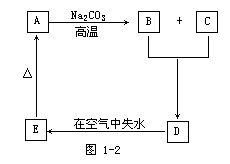
根据上述图示关系回答:
(1)各物质化学式A____,B____,C____,D____,E____。
(2)A变为B和C的化学方程式为_________,其反应原理是_________。
(3)B跟C生成D的化学方程式为____,其反应原理是______。
26.(8分)向碳酸钠的浓溶液中逐滴加入稀盐酸,直到不再生成二氧化碳气体为止,则在此过程中,溶液中的碳酸氢根离子浓度变化趋势可能是:A.逐渐减小;B.逐渐增大;C.先逐渐增大,而后减小;D.先逐渐减小,而后增大。你的选择是____(填正确选项的标号)。试用化学方程式和简要文字表达其理由。____________________
六、(本题包括2小题,共15分)
27.(10分)工业上可用乙基蒽醌(A)制备H2O2,其工艺流程可简单表示如下:

(1)A的分子式为______,B的分子式为_______。
(2)涉及氧化反应的反应式可写成:_______________。
涉及还原反应的反应式可写成:____________。
(3)“绿色化学”是当今社会人们提出的一个新概念。在绿色化学中,一个重要的衡量指标是原子的利用率,其计算公式为:原子利用率=期望产品的摩尔质量/化学方程式按计量所得产物的摩尔质量如
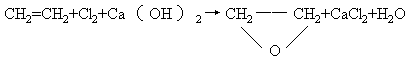 ,则制备
,则制备
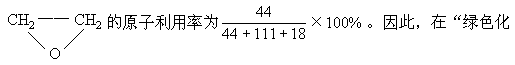
学工艺”中,理想状态原子利用就为100%,试问该法生锄H2O2可否称为理想状态的“绿色工艺”?简述理由。______________。
28.(5分)邻-甲基苯甲酸(
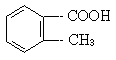 )多种同分异构体,其中属于酯类,且结构中含有苯环和甲基的同分异构体的结构简式为____、____、_____、____、_____、____(填不满,可以空着)。
)多种同分异构体,其中属于酯类,且结构中含有苯环和甲基的同分异构体的结构简式为____、____、_____、____、_____、____(填不满,可以空着)。
七、(本题包括2小题,共15分)
29.(6分)100.0g无水氢氧化钾溶于100.0g水。在T温度下电解该溶液,电流强度I=6.00安培,电解时间10.00h。电解结束温度重新调至 T,分离析出的KOH·2H2O晶体后,测得剩余溶液的总质量为 164.8g。已知不同温度下每100g溶液中无水氢氧化钾的质量为:
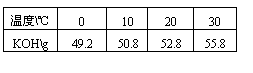
每摩电子的电量为 9.65×104c·mol-1(c为库仑)
求:(1)T温度时析出晶体KOH·2H2O的质量。
(2)析出晶体时的温度范围。
30.(9分)室温时,将盛有20mLNO2和O2混合气体的量筒倒立于盛有水的水槽中,一会儿,量筒里留下 3mL气体。则原混合气体中NO2为多少毫升?