2001北京市著名重点中学高考模拟试卷精选化学(第十模拟)
第Ⅰ卷 (选择题 共83分)
一、选择题(本题包括5小题,每小题3分,共15分。每小题只有一个选项符合题意。)
1.已知土壤胶体带负电荷,在土壤里施用含氮量相等的下列肥料时,肥效较差的是 [ ]
A.(NH4)2SO4
B.NH4HCO3
C.NH4NO3
D.NH4Cl
2.下列化学药品的保存方法不必要的是 [ ]
A.少量白磷保存在水中
B.盛苯酚晶体的试剂瓶要密封
C.铝片要隔绝空气密封保存
D.盛溴的试剂瓶中加入一些水
3.用聚苯乙烯泡沫塑料制成的一次性快餐餐具,由于难以降解,造成了对环境的白色污染。最近研制出一种新材料:
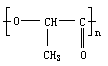 能替代聚苯乙烯,它是由乳酸(一种有机羧酸)缩聚而成,能在乳酸菌的作用下降解而消除对环境的污染。下列关于聚乳酸的说法正确的是
能替代聚苯乙烯,它是由乳酸(一种有机羧酸)缩聚而成,能在乳酸菌的作用下降解而消除对环境的污染。下列关于聚乳酸的说法正确的是
[ ]
A.聚乳酸是一种纯净物
B.聚乳酸的单体是
C.聚乳酸是一种羧酸
![]()
D.聚乳酸是由其单体通过加聚反应合成的
4.下列说法中正确的是 [ ]
①只有一种元素组成的物质,一定是纯净物
②所有酸性氧化物都是非金属氧化物
③硝酸和氢硫酸都既有氧化性,又有还原性
④碱性氧化物都是金属氧化物
A.都正确
B.①④
C.③④
D.②①
5.食用下列物质不会引起中毒的是 [ ]
A.加碘盐(含碘酸钾的食盐)
B.用甲醇兑制的白酒
C.用于混凝土防冻的亚硝酸钠
D.用碳酸钡作X射线透视的“钡餐”
二、选择题(本题包括8小题,每小题4分,共32分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该小题就为0分。)
6.分别处于第2、3周期的主族元素A和B,它们离子的电子层相差两层,已知A处于第m族,B处于第n族,A只有正化合价,则A、B的原子序数分别为 [ ]
A.m、n
B.3、7
C.m-2、10-n
D.m+2、10+n
7.下列各选项中所述的两个量,前者一定大于后者的是
[ ]
A.硼的同位素105B和115B所含的中子数
B.纯水在25℃和80℃时的pH
C.同温下,分别在100g水中最多能溶解的CuSO4与CuSO4·5H2O的质量
D.同温下,同物质的量浓度为CH3COONa溶液和CH3COONH4溶液中水的电离度
8.在水溶液中能大量共存,且加入过量稀H2SO4时既产生沉淀又有气体物质生成的离子组是 [ ]
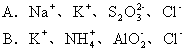
9.石墨晶体如图10-1所示,每一层由无数个正六边形构成,则平均每个正六边形成占有的碳原子数 [ ]
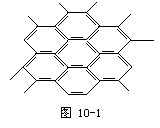
A.6个
B.4个
C.3个
D.2个
10.等体积的下列溶液,阴离子的总浓度最大的是 [ ]
A.0.2 mol/L K2S
B.0.1 mol/L Ba(OH)2
C.0.2 mol/L NaCl
D.0.2 mol/L(NH4)2SO4
11.下列关于氢元素的叙述中,错误的是 [ ]
![]()
学性质不相同

![]()
价
12.下列离子方程式错误的是 [ ]
A.向NaHSO4溶液中加入Ba(OH)2溶液呈中性:
![]()
B.向NaAlO2溶液中加入盐酸至溶液呈酸性:
![]()
C.在碳酸氢铵溶液中加入过量的NaOH溶液:
![]()
D.往苯酚钠溶液中通入足量的CO2:
![]()
13.在图10-2中x%为气态反应物在平衡体系中的质量分数,该图表示x%、同温度、压强的关系,符合曲线反应的是 [ ]
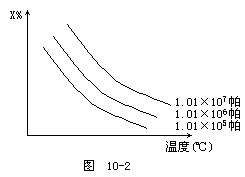
A.2NH3(气)
![]() N2(气)+3H2-Q
N2(气)+3H2-Q
B.H2(气)+I2(气)
![]() 2HI(气)+Q
2HI(气)+Q
C.4NH3(气)+3O2(气)
![]() 2N2(气)+6H2O(气)+Q
2N2(气)+6H2O(气)+Q
D.C(固)+H2O(气)
![]() H2(气)+CO(气)-Q
H2(气)+CO(气)-Q
三、选择题(本题包括9小题,每小题4分,共36分。每小题只有一个选项符合题意。)
14.现代合成氨工业的初始原料是空气、水、碳,若欲制8.5tNH3,则至少要耗碳为 [ ]
A.3.0t
B.4.5t
C.6.0t
D.9.0t
15.X和Y属短周期元素,X原子的最外层电子数是次外层电子数的一半,Y位于X的前一周期,且最外层只有一个电子,则X和Y形成的化合物的化学式可表示为 [ ]
A.XY
B.XY2
C.XY3
D.X2Y3
16.高氯酸铵在强热条件下分解,生成氮气、氧气、氯化氢和水。反应中生成的还原产物和氧化产物的物质的量之比是 [ ]
A.1∶2
B.5∶4
C.4∶7
D.7∶4
17.用下列方法来制备溶胶:①0.5 mol/LBaCl2溶液和等体积2 mol/L硫酸相混合并振荡;②把 1mL饱和三氯化铁溶液滴加入20mL沸水中,边加热边振荡;③把1mL水玻璃加入10mL 1 mol/L盐酸中,用力振荡。可行的是 [ ]
A.只有①②
B.只有①③
C.只有②③
D.①②③
18.在下列的叙述中,正确的是 [ ]
A.将碳酸钡放在水中不导电,碳酸钡是非电解质
B.二氧化硫水溶液能导电,二氧化硫是电解质
C.食盐晶体熔化或溶于水时,其化学键都被破坏
D.固体磷酸是电解质,所以它在熔化或溶于水时都能导电
19.在一定温度下,向足量的饱和Na2CO3溶液中加入1.06 g无水Na2CO3,搅拌后静置,最终所得晶体的质量为 [ ]
A.等于1.06 g
B.大于1.06 g,而小于2.86g
C.等于2.86g
D.大于2.86g
20.为了除去MgCl2酸性溶液中的Fe3+,可在加热搅拌的条件下加入一种试剂,过滤后再加入适量盐酸。这种试剂是 [ ]
A.NH3·H2O
B.NaOH
C.Na2CO3
D.MgCO3
21.下列反应中,气体反应物只能作还原剂的是 [ ]
A.氯气通入石灰水中
B.二氧化碳通入苯酚钠溶液中
C.一氧化氮与硝酸反应生成三氧化二氮和水
D.二氧化氮与水反应
22.苯环上的位置可用α、β表示,如
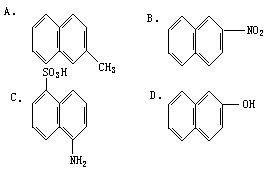
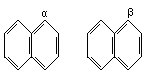 ,下列化合物中α位有取代基的是 [ ]
,下列化合物中α位有取代基的是 [ ]
第Ⅱ卷 (非选择题 共67分)
四、(本题包括2小题,共20分)
23.(6分)在6个集气瓶里分别盛有Cl2、N2、O2、CO2、NO2、NO等气体,试用最简单方法把它们鉴别出来。
答:____。
24.(14分)工业产品碳酸钠中,常混有氯化钠,测定碳酸钠质量分数的仪器装置如图10-3:
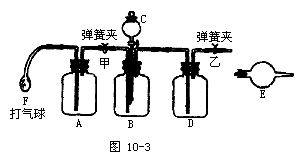
供选用的试剂有:NaOH溶液、饱和石灰水、蒸馏水、浓硫酸、稀硫酸、浓盐酸、稀盐酸、硝酸、碱石灰、无水氯化钙、无水硫酸铜、试样(含有少量氯化钠的碳酸钠)。
请回答:
(1)各有关仪器中使用的药品及作用。
A.____,作用____;B.____,作用____;C.____,作用____;
D.____,作用____;E.____,作用____;F的作用____。
(2)实验步骤(到得到实验数据止):
①称量:称试样质量及装有干燥剂的球形干燥管的质量,并记录数据。
②____;③____;④____;⑤____;⑥____;⑦____。
五、(本题包括2小题,共17分)
25.(9分)要使含K+、Ba2+、Al3+、Fe3+、Ag+的硝酸盐混合溶液进行分离并制成各自阳离子的硝酸盐溶液,现设计如下分离过程。所加入的试剂可从以下选用,氨水、NaOH、K2CO3、KOH、NaHCO3、HNO3、CH2OH(CHOH)4CHO。
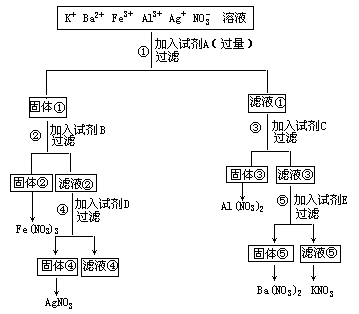
(1)请将上述实验步骤中所选用的试剂分子式和各种固体与滤液的成分(离子符合或分子式)填写在下表中。
(2)写出上述实验过程中步骤①~⑤的离子方程式。____。
26.(8分)图10-4A~D是中学化学实验中常见的几种温度计装置示意图。
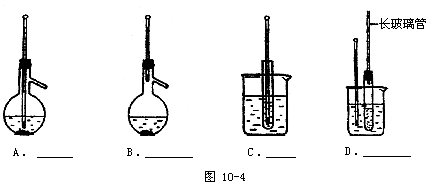
(1)请从①~⑧中选出必须使用温度计的实验,把编号填入最适宜的装置图A~C的空格中(多选要倒扣分)。
①酒精和浓硫酸混合加热制乙烯
②电石跟水反应制乙炔
③分离苯和硝基苯的混合物
④苯跟溴的取代反应
⑤石油的分馏实验
⑥浓盐酸和二氧化锰混合加热制氯气
⑦测定硝酸钾在水中的溶解度
⑧食盐和浓硫酸混合加热制氯化氢。
(2)选用装置D做苯的硝化实验,D中长玻璃管的作用是____。
六、(本题包括2小题,共15分)
27.(10分)下面是3种有机物结构式和名称(数字为碳原子编号):
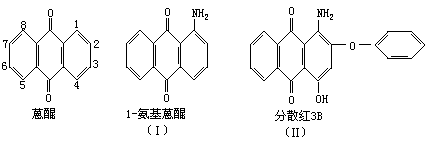
用化合物(Ⅰ)为起始原料,经过3步主要反应可以得到化合物(Ⅱ)。

(1)请在以上3个化学方程式的方框内分别填入有关的化学式和化学式的化学计量数(即系数)。
(2)从第(ii)步反应的化学原理看,它既发生了取代反应又发生了氧化还原反应,其中氧化剂是____;配平后的化学方程式中转移了____mol电子。
(3)请将反应式(iii)箭号下面的K2CO3改写在化学方程式的左端,重新另写出它的化学方程式,并配平之。____。
28.(5分)以乙烯为初始反应物可制得正丁醇(CH3CH2CH2CH2OH)。
已知两个醛分子在一定条件下可以自身加成。下式中反应物的中间产物(Ⅲ)可看成是由(Ⅰ)中的碳氧双键打开,分别跟(Ⅱ)中的2-位碳原子和2-位氢原子相连而得。(Ⅲ)是一种3-羟基醛,此醛不稳定,受热即脱水而生成不饱和醛(烯醛):
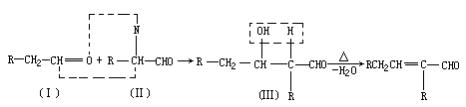
请运用已学过的知识和上述给出的信息写出由乙烯制正丁醇各步反应的化学方程式(不必写出反应条件)____。
七、(本题包括2小题,共15分)
29.(6分)臭氧能与KI溶液反应,生成一种可使带余烬的木条复燃的气体,向反应后溶液中滴入酚酞变成红色,若滴入淀粉溶液则变成蓝色。为测定大气中臭氧的含量,将0℃,1.01×105Pa,33.6m3的空气通过KI溶液,使之完全反应,在所得溶液中用0.01mol/L的Na2S2O3溶液60mL恰好与之反应完全(反应式为2Na2S2O3+I2=Na2S4O6+2NaI)。
(1)完成下列方程式:O3+KI+H2O→____
(2)计算大气中臭氧的体积分数。
30.(9分)在200mLFeCl3和FeCl2的混合溶液中,加入0.01 mol铁粉恰好完全反应,溶液中无Fe3+,取反应后溶液的与Cl2反应,溶液中Fe2+有80%被氧化成Fe3+,向通入Cl2后的溶液中再滴入AgNO3溶液,产生白色沉淀0.028 mol,求原溶液中FeCl3和FeCl2的物质的量浓度各多少?