试卷类型: A
08届高考化学第一次模拟考试试卷
考生须知: l、本试卷分选择题和非选择题二部分,共计150分,考试时间为120分钟。
2、选择题答题时,选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑。
3、可能用的相对原子质量:H:1 C: 12 O: 16 Cl : 35.5 Na: 23 Al: 27 Fe: 56。
第一部分选择题(共 70 分)
一、选择题(每小题只有一个正确答案,每小题3分,10小题共30分)
1、一定量的锎(98252Cf)是有用的中子源,1mg(98252Cf)每秒约放出2. 34xl99个中子,在医学上常用作治疗恶性肿瘤的中子源。下列有关锎的说法错误的是
A、(98252Cf)原子中,中子数为154 B、(98252Cf)原子中,质子数为98
C、(98252Cf)原子中,电子数为 98 D、锎元素的相对原子质量为252
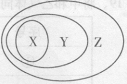 2、用右图表示的一些物质或概念间的从属关系中不正确的是( )
2、用右图表示的一些物质或概念间的从属关系中不正确的是( )
| X | Y | Z | |
| 例 | 氧化物 | 化合物 | 纯净物 |
| A | 苯的同系物 | 芳香烃 | 芳香族化合物 |
| B | 胶体 | 分散系 | 混合物 |
| C | 电解质 | 离子化合物 | 化合物 |
| D | 碱性氧化物 | 金属氧化物 | 氧化物 |
3、以下推理正确的是()
A、由甲酸可以发生银镜反应可推出其余的梭酸也均能发生银镜反应
B、NaCl与CsCl化学式相似,故NaC与CsCl的物理性质也相似
C、由“2Fe + 3Cl2= 2FeC13 ”反应可推出“2Fe + 3I2=ZFeI3”反应也能发生
D、由 H2O的沸点大于H2S的沸点可推知NH3 的沸点大于 PH3 的沸点
4、有机物分子中原子间(或原子与原子团间)的相互影响会导致物质化学性质的不同。下列事实不能说明上述观点的是
A、苯酚能跟NaOH溶液反应,乙醇不能与NaOH溶液反应
B、乙烯能发生加成反应,乙烷不能发生加成反应
C、甲苯能使酸性高锰酸钾溶液褪色,乙烷、苯不能使酸性高锰酸钾溶液褪色
D、苯与硝酸在加热时发生取代反应,甲苯与硝酸在常温下就能发生取代反应
5、下表为各物质中所含有的少量杂质,以及除去这些杂质应选用的试剂或操作方法。
| 序号 | 物质 | 杂质 | 除杂质应选用的试剂或操作方法 |
| ① | KNO3溶液 | KOH | 加入FeC13溶液,并过滤 |
| ② | FeSO4 | CuSO4 | 加入过量铁粉,并过滤 |
| ③ | H2 | CO2 | 通过盛有NaOH溶液的洗气瓶,再通过盛有浓硫酸的洗气瓶 |
| ④ | NaNO3 | CaCO3 | 溶解、过滤、蒸发 |
正确的一组为
A、①②③④ B、③④ C、②③④ D、①②③
6、可以将反应Zn + Br2= ZnBr2设计成可充电电池,下列4 个电极反应:
![]()
其中表示充电时的阳极反应和放电时的负极反应的分别是( )
A、②和③ B、②和① C、③和① D、④和①
7、世界著名的科技史专家、英国剑桥大学的李约瑟博士考证说:“中国至少在距今3000年以前,就已经使用玻璃了。”下列有关玻璃的说法不正确的是
A、制普通玻璃的原料主要是纯碱、石灰石和石英
B、玻璃在加热熔化时有固定的熔点
C、普通玻璃的成分主要是硅酸钠、硅酸钙和二氧化硅
D、盛放烧碱溶液的试剂瓶不能用玻璃塞,是为了防止烧碱跟二氧化硅生成硅酸钠而使瓶塞与瓶口粘在一起
8、下列说法正确的是
A、纯碱、CuSO4·5H2O和生石灰分别属于盐、混合物和氧化物
B、NH3、硫酸钡和水分别属于非电解质、强电解质和弱电解质
C、Mg、Al、Cu可以分别用置换法、直接加热法和电解冶炼法得到
D、合金的硬度一般比它各成分金属的硬度小,熔点一般比它各成分金属的熔点高
9、做实验时不小心沾了一些KMnO4,皮肤上的黑斑很久才能消除,如果用草酸的稀溶液洗涤马上可以复原,其离子方程式为:![]() (未配平)。关于此反应的叙述正确的是
(未配平)。关于此反应的叙述正确的是
A、该反应的氧化剂是 H2C2O4 B、 l molMnO4-在反应中失去 5 mol 电子
C、该反应右框内的产物是OH— D、配平该反应后,H+的计量数是 6
10、X、Y、Z是3种短周期元素,其中X、Y位于同一主族,Y、Z位于同一周期。X原子的最外层电子数是其电子层数的3倍。Z原子的核外电子数比Y原子少l 。下列说法不正确的是
A、元素非金属性由弱到强的顺序为Z < Y < X
B、Y元素最高价氧化物对应水化物的化学式可表示为 H2YO4
C、3种元素的气态氢化物中,Z的气态氢化物最稳定
D、原子半径由大到小的顺序为 Z > Y >X
二、选择题(每小题有l~2个正确答案,每小题4分,10小题题共40分)
11、氯酸是一种强酸,室温下,浓度超过40%时就会发生分解,反应可表示为:
![]() 用湿润的淀粉碘化钾试纸检验气体产物时,试纸先变蓝后褪色。下列说法正确的是 A、由反应可确定:氧化性HC1O4>HC1O3
用湿润的淀粉碘化钾试纸检验气体产物时,试纸先变蓝后褪色。下列说法正确的是 A、由反应可确定:氧化性HC1O4>HC1O3
B、变蓝的淀粉碘化钾试纸褪色是因为可能发生了:![]()
C、若氯酸分解所得混合气体,lmol混合气体质量为52.5g,则反应方程式可表示
![]()
D、若化学计量数a = 8 , b = 3 ,则该反应转移电子数为20e—
12、化学实验设计和操作中必须十分重视安全问题和环境保护问题。下列实验问题处理方法不正确的是 ① 在制氧气时排水法收集氧气后出现倒吸现象,立即松开试管上的橡皮塞 ② 在气体发生装置上直接点燃一氧化碳气体时,必须要先检验一氧化碳气体的浓度。最简单的方法是用排空气的方法先收集一试管气体,点燃气体,听爆鸣声 ③ 实验结束后将所有的废液倒入下水道排出实验室,以免污染实验室 ④ 给试管中的液体加热时不时移动试管或加入碎瓷片,以免暴沸伤人 ⑤ 不慎将酸溅到眼中,应立即用水冲洗,边洗边眨眼睛 ⑥ 配制稀硫酸时,可先在烧杯中加一定体积的水,再边搅拌边加入浓硫酸
A、①② B、②③ C、③⑤ D、②⑥
13、下列离子方程式正确的是
A、向Ba(OH)2溶液中滴加NH4HSO4溶液至刚好沉淀完全:![]()
B、向Ca(HCO3)2溶液中加入少量Ca(OH)2溶液:![]()
C、在NaOH溶液中通入少量的SO2气体:![]()
D、二氧化硅和氢氧化钠溶液反应:![]()
14、NA表示阿伏加德罗常数,下列叙述中正确的是
A、0.1mol Fe与0.lmol Cl2充分反应,转移的电子数为0.3NA
B、标准状况下,11.2LNO2和11.2LN2O4的混合,平衡时所含的分子数为l.5NA
C、2.0gD20中所含中子数为0.1NA
D、常温常压下, 229 氧气和 269 臭氧所含氧原子总数为 3N ^
15、将总物质的量为n mol的钠和铝(其中钠的物质的量分数为x ) ,投入一定量的水中充分反应,金属没有剩余,共收集到标准状况下的气体VL 。下列关系式中正确的是![]()
16、在指定环境中,下列各组离子可以大量共存的是
A、在中性溶液中:Al3+、K+、S042—、 HCO3—
B、在0.1mol/L的氯化铁溶液中:Fe3+、NH4+、NO3—、Cl—
C、在PH =11的溶液中:S2一、S032—、K+、Na+、C032—
D、在酸性溶液中: AlO2—、K+、I一、NO3—、Na+
17、世界上60%的镁是从海水中提取的,其主要步骤如下: ① 把贝壳制成石灰乳; ② 在海水中加人石灰乳,过滤,洗涤沉淀物; ③ 将沉淀物与盐酸反应,结晶、过滤; ④ 在氯化氢热气流中干燥晶体; ⑤ 电解上述晶体的熔融物。下列说法正确的是
A、镁元素在元素周期表中位于第三周期、ⅡA 族
B、向洗涤液中滴加碳酸钠溶液可检验沉淀是否洗涤干净
C、在氯化氢热气流中干燥晶体的目的是加快干燥速度
D、步骤 ⑤ 也可以采用电解该晶体水溶液的方法
18、下列溶液中各微粒的浓度关系正确的是
A、物质的量浓度相等的C(NH4)2 SO4、NH4HSO4、NH4Cl溶液中C(NH4+) : ![]()
B、向醋酸钠溶液中加入适量酷酸,得到的酸性混合溶液:![]()
C 、某二元弱酸的酸式盐NaHA溶液中:![]()
D、1.0mol/LNa2C03溶液:![]()
19 、将甲和乙气体同时通入过量丙溶液中,可能产生沉淀的组合是
| 序号 | |||
| ① | CO2 | SO2 | Ca(OH)2 |
| ② | HCl | CO2 | Ca(OH)2 |
| ③ | CO2 | SO2 | Ba(NO3)2 |
| ④ | NO2 | SO2 | CaCl2 |
| ⑤ | CO2 | NH3 | CaCl2 |
| ⑥ | O2 | NH3 | AlCl3 |
20、如右图所示a、b是多孔石墨电极,某同学按图示装置进行如下实验:断开K2,闭合K1,一段时间(上为K2,下为K1) ,观察到两只玻璃管内都有气泡将电极包围,此时断开K1,闭合K2,观察到电流计A的指针有偏转。下列说法不正确的是
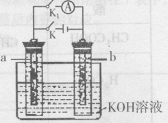 A、断开K2,闭合K1一段时间,溶液的pH要变大
A、断开K2,闭合K1一段时间,溶液的pH要变大
B、断开K1,闭合K2时,b 极上的电极反应式为:
![]()
C、断开K2,闭合K1时,a 极上的电极反应式为:
![]()
D、断开K1,闭合K2时, OH一向b极移动
第二部分非选择题(共 80 分)
三、(本题包括3小题,共31分)
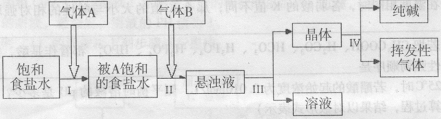
21、(10分)侯氏制碱法原理是:将NH3和CO2气体通人饱和食盐水中即可获得NaHCO3和NH4Cl 的混合物,然后分离出 NaHCO3 再加热制得纯碱。其流程如下:
参照下表:
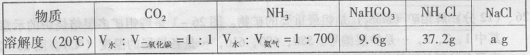
回答下列问题:
(l)气体A、B依次是:( )
A、CO2 ,NH3 B、NH3 ; CO2 C、任何顺序都可以
(2)写出(I)和(Ⅱ)步骤总的化学反应方程式:
由反应原理可知,a 9.6(填“ < ”、“ > ”或“ = " )
(3)操作(Ⅲ)的名称是: ,化学实验室进行该操作用到的玻璃仪器有: 。
(4)经步骤(Ⅲ)所得液体中含有的盐为(写化学式): 经过 (填操作名称)后可以得到化肥。
(5)每当通入NH3 44.8L(已折合成标准状况下)时可以得到纯碱100.0g,则NH3的利用率为
22、(10分)某实验小组在进行双氧水分解的实验时发现:大家取相同体积、不同浓度的双氧水及不同质量的二氧化锰进行的实验,产生气体的速率都不相同,那么过氧化氢分解的最佳催化条件是什么呢?他们决定进行探究。
(l)用下列简图,在答题卡的方框中画出实验装置(含试剂)示意图。( 3 分)
(2)小组经过实验,取得如下数据: ( 7 分)

(说明:表中X是二氧化锰的质量;Y是指反应停止时的时间;Z是双氧水的含量)
分析表中数据回答下列问题:
①相同浓度的双氧水的分解速率随着二氧化锰用量的增加而 。
②从实验效果和“绿色化学”的角度考虑,双氧水的浓度相同时,加入 g的二氧化锰为较佳选择,理由是
③该小组的小茂同学分析上述数据后认为:“当用相同质量的二氧化锰时,双氧水的浓度越小,所需要的时间就越少,亦即其反应速率越快”的结论,你认为是否正确 ,理由是
23、(11分)某溶液中可能含有C032—、S042—、 HCO3—三种离子中的一种或两种。为探究其组成,小明取出两份相同的样品溶液于试管中,向一份中加入过量的盐酸,产生无色气泡;向另一份中滴加过量的氯化钡溶液,产生白色沉淀。请设计合理实验,在小明实验的基础上做进一步的实验,对小明的实验给出结论。
仅限选择的仪器、用品和试剂:烧杯、试管、玻璃棒、胶头滴管、量筒、集气瓶、铁架台、漏斗、滤纸、酒精灯;lmol/L硫酸;2mol/L盐酸;2mol/L硝酸、;lmol/L氯化钡、澄清石灰水、蒸馏水。
完成下列探究过程:
(l)提出假设:
假设 l :溶液中只存在C032— 假设 2 :
假设 3 : 假设 4 :溶液中存在S042—、 HCO3—
(2) 基于假设4 , 设计出实验方案,将实验操作、预期的实验现象和结论填在下表中。
[提示]I、在答题卡上按照下表的方式作答,注意前后内容的对应。
Ⅱ、注意文字简洁,超出答题卡空间视为无效。
III 、可不填满,也可增加步骤。
| 步骤编号 | 实验操作 | 预期现象和结论 |
| ① | ||
| ② | ||
| ③ | ||
| ④ |
四、(本题包括3小题,共30分)
24、(10分)制取纯净CuCl2·2H20的生产过程是: (l)用粗CuO(含少量铁)溶解在足量的稀盐酸里加热、过滤,得到Cu Cl2(含FeCl2)的溶液,经测定,溶液的PH值为3 。 (2)对(l)的溶液按下列步骤进行提纯: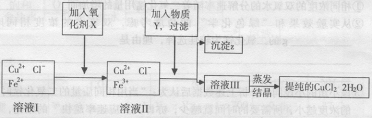
已知:①可做氧化剂的物质有(A) KMnO4(B) K2Cr2O7 (C) H2O2 (D)NaClO
②Cu2+、Fe2十在PH值为4一5时不水解,而Fe3+却几乎全部水解。试回答:
(l)加入的氧化剂x是(答编号): ; 加入x 的作用是: ; 反应的离子方程式是:
(2)物质 Y 是 ;沉淀z是 。加入Y 能形成沉淀z的原因是
(3)分离出沉淀z,并将溶液班蒸发欲获得晶体CuCl2·2H20。采取什么措施才能顺利得到晶体CuCl2·2H20?
25、(8分)与化学平衡类似,电离平衡的平衡常数,叫做电离常数(用 K 表示, K 只与温度有关)。下表是几种常见弱酸的电离平衡常数(25℃)。
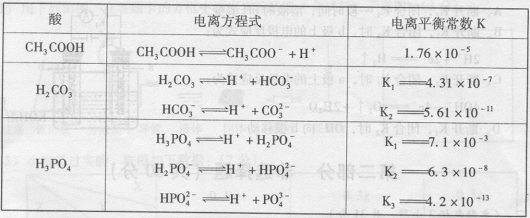
回答下列各题: (l)温度升高时, (填“促进”或“抑制”)弱酸的电离, K 值 (填“增大”、“减小”或“不变”)。
(2)在温度相同时,各弱酸的K值不同,那么K值的大小与酸性的相对强弱关系是
。
(3)若把![]() 都看作是酸,则它们酸性强弱顺序是
。
都看作是酸,则它们酸性强弱顺序是
。
(4) 25℃时,若醋酸的起始浓度为0.0l0mol/L ,则平衡时溶液的pH是多少?(写出计算过程,结果以对数形式表示)
26、(12分)辉钼矿(MoS2)是钼最重要的矿物。图26一l是辉钼矿多层焙烧炉的示意图,其中1,2,3,…是炉层编号。580,600,610,… 是各炉层的温度(℃)。图26一2给出了各炉层的固体物料的摩尔百分组成。已知:MoS2焙烧生成1molMoO3的反应热为 △H1=一1011 KJ/mol, MoO2氧化生成lmolMoO3的反应热为△H2=一154KJ/mol。试回答:
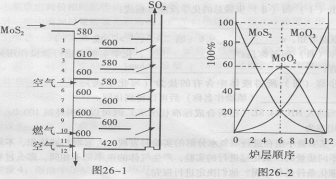
(l)辉铝矿焙烧生成MoO3的反应中被氧化的元素是: (填元素符号);指出辉钼矿焙烧生成的尾气对环境的一种危害:
(2)第6炉层存在的固体物质分别是: 它们的物质的量之比是:
(3)辉钼矿焙烧生成MoO3的热化学反应方程式是:
(4)图26一2表明,中间炉层(4一6)可能存在一种“固体+固体、固体+ … ”的反应,请写出该反应的化学方程式:
(5)通过(3)和(4)你能解释为什么中间炉层(4一6)的炉温比上下炉层的炉温低吗?
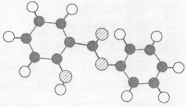 五、(本题包括1个小题,9分)
五、(本题包括1个小题,9分)
27、(9分)萨罗(Salol)是一种消毒剂,它的分子模型如图所示(图中球与球之间的连线代表化学键,如单键、双键) : (l)根据上图模型写出萨罗的结构简式: 。 (2)写出萨罗分子结构中含有官能团的名称: 。
(3)萨罗经水解、分离、提纯可得到纯净的苯酚和水杨酸。请写出其水解方程式:
(4)写出同时符合下列四种条件的水杨酸的同分异构体共有 种。 ①含有苯环; ②能发生银镜反应,不能发生水解反应;③在稀NaOH溶液中,1 mol该同分异构体能与2mol NaOH发生反应;④只能生成两种一氯代产物。
(5)从(4)确定的同分异构体中任选一种,指定为下列框图中的A。
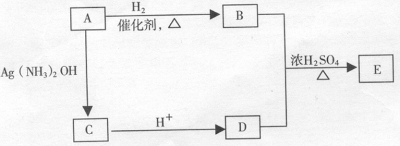
写出下列反应的化学方程式:
B + D→E : 该反应属于 反应。六、选做题(本题包括2小题,每题10分,考生只能选做一题,28 小题为“物质结构与性质”内容的试题 ,29 题为“有机化学基础”内容的试题)。
28、(10分)奥美拉哇(OmePrazole)是基于2005年诺贝尔医学奖成果研制的药物,该药物对幽门螺旋杆菌引起的胃及十二指肠溃疡根治率最高。奥美拉哇的合成路线如下(Me表示甲基):
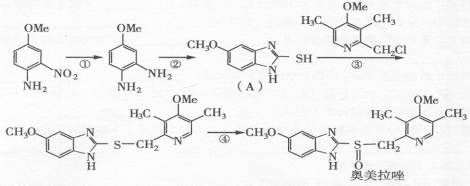
试回答下列问题: (l)奥美拉哇的分子式是:
(2)指出下列反应的类型: ① ; ③
(3)反应②是与一种无机小分子在氢氧化锂催化下发生的反应,二者各一分子反应在得到 A 的同时还得到一分子的硫化氢,则该无机小分子的化学式为: 。
(4)反应④是用液态氧化剂氧化而发生的反应,除生成奥美拉哇外还生成水,请写出④的化学反应方程式:
(5)根据结构判断奥美拉哇可能发生的化学反应是:
A、与氢氧化钠发生水解反应 B、能与氯气发生加成反应
C、与乙酸发生酯化反应 D、能使酸性高锰酸钾溶液褪色
29、(10分)Al和Si、Ge和As在元素周期表金属和非金属过渡位置上,在其单质和化合物在建筑业、电子工业和石油化工等方面应用广泛。请回答下列问题:
(1) As 的价层电子构型为
(2) AlCl3是化工生产中的常用催化剂,熔点为192.6℃,熔融状态以二聚体A12C16形式存在,其中铝原子与氯原子的成键类型是
(3)超高导热绝缘耐高温纳米氮化铝(AlN)在绝缘材料中的应用广泛,AlN晶体与金刚石类似,每个Al原子与个N原子相连,与同一个Al原子相连的N原子构成的空间构型为。在四大晶体类型中,AlN属于 晶体。
(4)Si和C 同主族,Si、C和0成键情况如下:
在C和0之间可以形成双键形成CO2分子,而Si和O则不能和碳那样形成有限分子原因是
(5)SiCl4(l)常用作烟雾剂,原因Si存在3d轨道,能同H20 (l)配位而剧烈水解,在潮湿的空气中发烟,试用化学方程式表示其原理
高考模拟考试化学试题参考答案及评分标准
1~5、D、C、D、B、C 6~10、A、B、B、D、C
11~15、BD、B、AB、D、D 16~20、C、AB、AD、D、B
21、(10分)(l) B![]() (3)过滤;烧杯、玻璃棒、漏斗。 (4) NaHCO3、NH4Cl (
NaCl写与不写不扣分,只写其中一种不给分);结晶 (5) 94.34% (2分)(除标明的以外,其它各空均为 l 分。)
(3)过滤;烧杯、玻璃棒、漏斗。 (4) NaHCO3、NH4Cl (
NaCl写与不写不扣分,只写其中一种不给分);结晶 (5) 94.34% (2分)(除标明的以外,其它各空均为 l 分。)
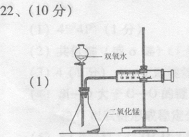 (3分,不画活塞扣 1 分,不标试剂扣 1 分)
(3分,不画活塞扣 1 分,不标试剂扣 1 分)
(2) ①加快; (l分)0.3 (l分);因为用0.1g的催化剂反应速率明显的小于用0.3g和0.5g的催化剂;用0.5g 的催化剂和用0.3g的催化剂反应速率和反应时间相差不多,但用0.3g的催化剂却节约药品,所以使用0.3g二氧化锰为较佳选择。(2分) ③不正确( 1 分)。因为从表中数据可知,相同体积3.0%的双氧水中的溶质含量是1.5%的二倍,但反应的时间却比其反应时间的二倍小得多,由反应速率计算公式 ( v=△c/△t)可得出,此实验条件下双氧水的浓度越大分解速率越快。( 2 分)
23、(11分) (l)假设2 :溶液中存在CO32—和HCO3—( 2 分)
假设3、溶液中存在CO32—和SO42—(2和3顺序不限。)(2分)(2)①用胶头滴管取少量溶液加入试管中,再用滴管取过量的lmol/L氯化钡溶液并滴加到试管A中,充分反应后,静置,然后过滤,将沉淀和滤液分别装入另外的两个试管中(2分);产生白色沉淀。 ②往装有沉淀的试管中加入过量的2mol/L盐酸;沉淀不溶解,说明原溶液中一定含有SO42—而无CO32—。 ③往装有滤液的试管中加入2mol/L盐酸;出现无色气泡,说明原溶液中含有HCO3—。(除标明分数的以外,每空各 1 分。)
24、(10分)(1)C;把Fe2+氧化成Fe3+; 2Fe2++ H2O2+2H+ = 2Fe3++2HZO( 2 分)
(2) CuO或Cu(OH)2或CuC03 ; Fe(OH)3 (若有 Y 也不扣分); CuO与H+反应,使溶液的PH 值升高,促进了Fe3+的水解,当PH值为4一5时,Fe3+几乎完全水解生成Fe(OH)3。(2 分) (3)用HCl气体做保护气,防止CuCl2水解。( 2 分)(或在HCl气体气氛下)(除标明的分数外,其它每空均为 1 分。)
25、(8分) (l)促进、增大( 2 分) (2) K 值越大,酸性越强( 2 分)
![]()
![]()
26、(12分) (1) Mo和S;形成酸雨(合理即得分)。(每空各 l 分)
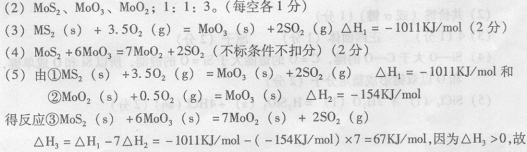 反应③是吸热反应,因其发生在中间层,故炉温降低。( 4 分)
反应③是吸热反应,因其发生在中间层,故炉温降低。( 4 分)
27、(9分)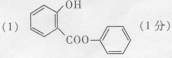 (2)羟基、酯基、苯环( 2 分)
(2)羟基、酯基、苯环( 2 分)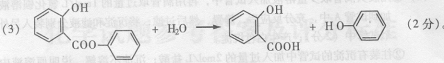 (4) 2 (l分)。
(4) 2 (l分)。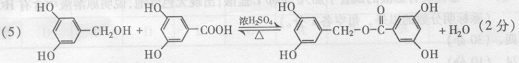

28、(10分) (1) Cl17H19N303S ( 2 分) (2)还原;取代(各 1 分) (3) CS2( 2 分)
(4)氧化剂为H2O2,方程式略。( 2 分) (5) B、D ( 2 分)
29、(10分) (l) 4s24p3( l 分) (2)共价键(或σ键) (l分)
(3) 4 (l分)正四面体(l分)原子(2分) (4) Si一0大于C一0的键,C=0的键能大于Si=O的键能,所以Si和O成单键,而C和O以双键形成稳定分子( 2 分)
(5)SiCl4(l) + 3H2O (l) = H2Si03 (s) + 4HCl(aq) ( 2 分)