高考理综化学模拟试题(二)
可能用到的相对原子质量:H-1 C-12 O-16 Cl-35.5
6.引起下列环境污染的原因不正确的是
A.重金属、农药和难分解有机物等会造成水体污染
B.SO2、NO2或CO2都会导致酸雨的形成
C.装饰材料中的甲醛、芳香烃及氡等会造成居室污染
D.CO2和氟氯烃等物质的大量排放会造成温室效应的加剧
7.下列指定微粒数目不是1 : 1的是
A.Na2O2晶体中的阳离子和阴离子 B.NaHCO3晶体中的阳离子和阴离子
C.![]() Mg2+离子中的质子和中子 D.醋酸钠溶液中的阳离子总数与阴离子总数
Mg2+离子中的质子和中子 D.醋酸钠溶液中的阳离子总数与阴离子总数
8.下列各组离子中,一定能大量共存的是:
A.加入铝粉有氢气产生的溶液中:Na+、SO3![]() 、C1-、K+
、C1-、K+
B.PH = 0的溶液中:Na+、K+、Fe 2+、NO3-
C.在水电离产生的c(OH-)= 1×10-13溶液中:Ba2+、NO3-、ClO-、Ca2+
D.在c(H+)/c(OH-)= 1×1013的溶液中:NH4+、Ca2+、C1-、K+
9.要提纯下列物质(括号内物质为杂质),实验操作最合理的是
A.CO2(SO2):通入盛有饱和NaHCO3溶液的洗气瓶
B.溴苯(Br2):加入KI溶液,充分反应后,弃去水溶液
C.己烷(己烯):加入足量的溴水,充分振荡,静置分层后分离
D.乙酸乙酯(苯酚):加入NaOH溶液,振荡、静置分层后,除去水层
10.下列反应的离子方程式书写正确的是
A.碳酸氢镁溶液和过量NaOH溶液的反应:Mg2+ +2HCO32-+ 2OH-= MgCO3↓+2H2O
B.NaHSO4溶液中滴加NaHCO3溶液:H++![]() =H2O+CO2↑
=H2O+CO2↑
C.亚硫酸钠和足量的稀硝酸混合:SO32-+ 2H+ = SO2↑+ H2O
D.硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液:Fe2+ +2H+ + H2O2 = Fe3+ + 2H2O
11、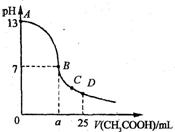 25℃时,在25 mL o.1
mol·L-1的NaOH溶液中,逐滴加入 0.2 mol·Lˉ1的CH3COOH溶液。溶液pH的变化曲线如图所示。下列分析的结论中,不正确的是
25℃时,在25 mL o.1
mol·L-1的NaOH溶液中,逐滴加入 0.2 mol·Lˉ1的CH3COOH溶液。溶液pH的变化曲线如图所示。下列分析的结论中,不正确的是
A.B点的横坐标a>12.5
B.C点时c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
C.D点时c(CH3COO-)+c(CH3COOH)=2c(Na+)
D.曲线上A、B间任一点,溶液中都有:
c(Na+)>c(CH3COOˉ)>c(OH-)>c(H+)
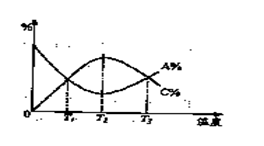 12.在一恒容密闭容器中,某一反应物,生成物都为气体, A、C两种物质的含量(A%. C%)随温度的变化曲线如右图所示。下列说法正确的是(
)
12.在一恒容密闭容器中,某一反应物,生成物都为气体, A、C两种物质的含量(A%. C%)随温度的变化曲线如右图所示。下列说法正确的是(
)
A、该可逆反应中是A反应物, C是生成物。建立平衡后,升高温度向正反应方向移动
B、该可逆反应在温度T1.T3时正 逆反应速率相等
C、该可逆反应在温度T2时达到化学平衡。
D、该可逆反应的正反应是吸热反应。
13.我国支持“人文奥运”的一个重要体现是:坚决反对运动员服用兴奋剂。某种兴奋剂的结构简式如右图所示,有关该物质的说法正确的是: ( )
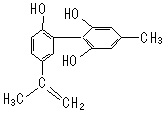 A.遇FeCl3溶液显紫色,因为该物质与苯酚属于同系物
A.遇FeCl3溶液显紫色,因为该物质与苯酚属于同系物
B.滴入酸性KMnO4溶液,观察紫色褪去,能证明结构
中存在碳碳双键
C.1mol该物质分别与浓溴水和H2反应时最多消耗Br2
和H2分别为4mol、7mol
D.该分子中的所有碳原子有可能共平面
26.(15分)A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大。A与D同主族;C与E同主族;B、C同周期;B原子最外层电子数比其次外层电子数多2;A、B两元素的核电荷数之差等于它们的原子最外层电子数之和;F元素是同周期元素中原子半径最小的主族元素。A、B、C、D、E、F形成的化合物甲、乙、丙、丁、戊、己的组成如下表所示。
| 化合物 | 甲 | 乙 | 丙 | 丁 | 戊 | 己 |
| 化学式 | A2C | A2C2 | B2A2 | D2C2 | A2E | DF |
回答下列问题
(1)化合物丙的电子式为 。化合物丁存在的化学键类型是 。
(2)化合物甲的沸点比戊 (填“高”或“低”),原因是
(3)向含有0.2mol乙的水溶液中加入少量MnO2,使乙完全反应,发生转移的电子数目为 个。
(4)2.0g丙完全燃烧,生成液态甲和B的气态氧化物,放出99.6KJ的热量,请写出表示丙的燃烧热的热化学方程式
(5)用铁作阳极、石墨作阴极,电解甲、己的混合溶液,电解反应的方程式为:
27.(15分)实验室可以用纯净的氯气和铁粉反应制取少量氯化铁固体,其反应装置如图所
|
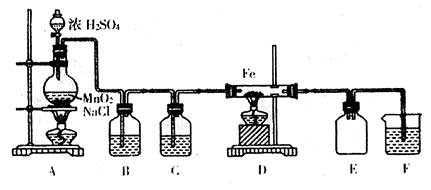
回答下列问题:
(1)该实验用NaCl固体、MnO2粉末和浓H2SO4共热来制取氯气,在实验室经常用MnO2粉末直接氧化浓HCl,请写出用MnO2粉未氧化浓HCl的反应的离子方程式
。
(2)装置B中盛放的试剂是 。
(3)装置E的作用是 。
(4)如果没有装置C,水蒸气将混入D中,铁粉与水蒸气在高温下也可反应,写出该反应的方程式
(5)装置F中反应的离子方程式是 。
(6)氯化铁固体易潮解。为防止氯化铁发生水解反应,在上述示意图中 和
之间应再接入装置 (填写A—F字母)
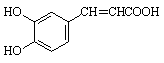
28.(16分)咖啡酸(下式中的A)是某种抗氧化剂成分之一,A与FeCl3溶液反应显紫色。
(1)咖啡酸中含氧官能团的名称为___________________________________________。
(2)咖啡酸可以发生的反应是____________________________________(填写序号)。
① 氧化反应 ② 加成反应 ③ 酯化反应 ④ 加聚反应 ⑤ 消去反应
(3)咖啡酸可看作1,3,4—三取代苯,其中两个相同的官能团位于邻位,取代基中不含支链。则咖啡酸的结构简式为_______________________________________。
(4)3.6 g咖啡酸与足量碳酸氢钠反应生成气体(标准状况)______________mL。
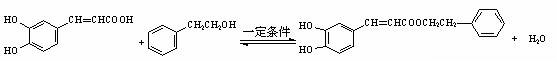
(5)蜂胶的主要活性成分为CPAE,分子式为C17H16O4,该物质在一定条件下可水解生成咖啡酸和一种醇,该醇为芳香醇,且分子结构中无甲基,则咖啡酸跟该芳香醇在一定条件下反应生成CPAE的化学方程式为__________________________________________________。
29.(16分)下表由元素周期表的前三周期去掉副族上方的空白区域后组合而成,表中虚线处为ⅡA、ⅢA族的连接处。请用相应的化学用语回答下列问题:
| a | |||||||
| b |
|
| c | d | e | f | |
| g | h | i |
(1)写出仅由e形成的两种带有相同电荷数的阴离子的符号: 、 。
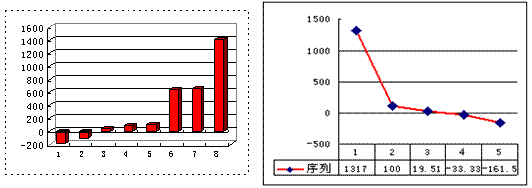
(2)上左图是表示第三周期8种元素单质的熔点(℃)柱形图,已知柱形“1”代表Ar,则其中柱形“8”代表 。(填化学式)
(3)b、c、d、e、f的氢化物的沸点(℃)直角坐标图(上右图),序列“5”的氢化物的名称是 ,序列“2”的氢化物的结构式为 。
(4)元素a与f形成的化合物不能保存在玻璃容器中,原因是(用化学方程式表示) 。
(5)元素e与i形成的化合物是一种广谱型的消毒剂,根据世界环保联盟的要求,此化合物将逐步取代Cl2成为自来水的消毒剂,此化合物的化学式为: ,它的晶体类型是: 。
(6)a元素和d元素组成的化合物的空间构型是 (不用画图),工业上合成此化合物的适宜条件是 。
化学部分
B A C A B D C C
26.(15分)
![]()
![]() (1)丙的电子式H:C C: H(2分) 离子键、非极性共价键(2分)
(1)丙的电子式H:C C: H(2分) 离子键、非极性共价键(2分)
(2)高(1分) 水分子间存在氢键而H2S分子中不存在氢键(2分)
(3)0.2·NA或1.204×1023(2分)
|
|
27.(15分)(1)MnO2+2Ci+4H+ Mn2++Cl2↑+2H2O(3分)
(2)饱和食盐水 (2分)
(3)安全瓶,防止倒吸(2分)
|
(4)3Fe+4H2O Fe3O4+4H2
(3分)
(5)2OH—+Cl2=Cl—+ClO—+H2O(2分)
(6)D E C(3分)
28.(14分)
(1)羧基(2分)、羟基(2分)
(2)①②③④(2分)
 |
(3) (2分)
(4)448(2分)
(5)(3分)
29.(16分)(1)O2- ……………(1分) O22-(或O2-、O3-)………………(1分)
(2)Si ……………………………………………………………………………(2分)
(3)甲烷……………………(1分) H—O—H ………………………(1分)
(4)SiO2+4HF=SiF4↑+2H2O ………………………(2分)
(5)ClO2 (2分) 分子晶体(2分)
(6)三角锥形 (2分) 20Mpa~50Mpa、500℃、铁触媒作催化剂………(2分)