高考化学科目第一次教学质量检测
化学试题卷
考生须知:
1.本卷满分100分,考试时间100分钟。
2.答题前,在答题卷密封区内填写学校、班级和姓名。
3.所有答案必须写在答题卷上,写在试卷上无效。
4.考试结束,只需上交答题卷。
相对原子质量:
H 1 C 12 O 16 Na 23 S 32 Cl 35.5 Al 27 N 14 P 31 Mg 24
一、选择题(每小题只有一个选项符合题意,每小题2分,共16分)
1.据2001年12月的《参考消息》报道,有科学家提出硅是“21世纪的能源”、“未来的石油”的观点。假如硅作为一种普遍使用的新型能源被开发利用,关于其有利因素的下列说法中,你认为不正确的是
A.硅便于运输、贮存,从安全角度考虑,硅是最佳的燃料
B.自然界中存在大量单质硅
C.硅燃烧放出的热量大,且燃烧产物对环境污染程度低,容易有效控制
D.自然界硅的贮量丰富
2.1934年居里夫妇用α粒子(4He)轰击27Al得到一种自然界不存在的核素-30P,开创了人造核素的先河。其发生的变化可表示如下:
27Al+4He→30P+1n。下列有关说法不正确的是
A.30P和 31P 两种核素互为同位素
B.该变化同样遵循质量守恒定律
C.该变化说明原子核在化学反应中也能发生变化
D.在30P中,质子数=中子数=核外电子数
3.下列物质中,既可与盐酸反应,又可与氢氧化钠溶液反应的是
①Na2SiO3;②AlCl3;③NH4HCO3;④Al2O3;⑤NaHSO4
A.①②④ B.②③⑤ C.②③ D.③④
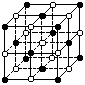 4.超氧化钾(KO2)的晶体结构与NaCl相似,其晶体结构如右图所示。下列对KO2晶体结构的描述正确的是
4.超氧化钾(KO2)的晶体结构与NaCl相似,其晶体结构如右图所示。下列对KO2晶体结构的描述正确的是
A.和阳离子距离相同且最近的阴离子共有8个
B.和阳离子距离相同且最近的阳离子共有6个
C.KO2的晶体中阴、阳离子个数比为1:1
D.该图中表示14个超氧化钾分子
5. 已知在25℃,101kPa下,l g C8H18(辛烷)燃烧生成二氧化碳和液态水时放出48.40kJ
热量。表示上述反应的热化学方程式正确的是
A .C8H18(1)+12.5O2(g)=8CO2(g)+9H2O(g); △H=-48.40kJ·mol-1
B.C8H18(1)+12.5O2(g)=8CO2(g)+9H2O(1); △H=-5518kJ·mol-1
C.C8H18(1)+12.5O2(g)=8CO2(g)+9H2O(1) ;△H=+5518kJ·mol-1
D.C8H18(1)+12.5O2(g)=8CO2(g)+9H2O(1); △H=-48.40kJ·mol-1
6.某单质X能从含元素Y的盐溶液中置换出Y单质,由此可知
A.当X、Y均为金属时,X一定比Y活泼
B.当X、Y均为非金属时,Y一定比X活泼
C.当X是金属时,Y一定是金属
D.当X是非金属时,Y可能是金属,也可能是非金属
7.几种短周期元素的原子半径及主要化合价见下表:
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | +2 | -2 |
下列叙述正确的是
A.L、R的单质与稀盐酸反应速率L<R
B.L与T形成的化合物具有两性
C.Q、T两元素的氢化物热稳定性Q<T
D.L、Q形成的简单离子核外电子数相等
![]() 8.维通橡胶是一种耐腐蚀、耐油、耐高温、耐寒性能都特别好的氟橡胶。它的结构简式如下:
合成它的单体是
8.维通橡胶是一种耐腐蚀、耐油、耐高温、耐寒性能都特别好的氟橡胶。它的结构简式如下:
合成它的单体是
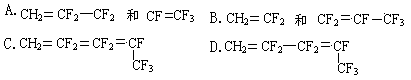
二、选择题(每小题只有一个选项符合题意,每小题3分,共24分)
9.下列各项中表达正确的是
![]()
![]() A.F原子结构示意图: B.CO2的分子模型:
A.F原子结构示意图: B.CO2的分子模型:
![]()
![]()
C.HCl的电子式为: D.NH3的结构式:
10.一定条件下硝酸铵受热分解的化学方程式(未配平)为:NH4NO3→HNO3+N2+H2O,在反应中被还原与被氧化的氮原子数之比为
A.
3:5 B.5:4 C.1:1
D. 5:3
11.阿伏加德罗常数约为6.02×1023mol-1,下列说法正确的是
A.1.0L 1mol/L氨水中,NH3·H2O的分子数为6.02×1023
B.2.4g金属镁变为镁离子时失去的电子数为0.2×6.02×1023
C.白磷分子(P4)呈正四面体结构,31g 白磷中含有P—P键个数为6×6.02×1023
D. 20g 重水(2H216O)中含有的中子数为8×6.02×1023
12.下列离子方程式书写正确的是
A.硫酸铝溶液中滴加过量浓氨水:Al3++4OH—=AlO![]() +2H2O
+2H2O
B.NaHCO3溶液水解:HCO![]() +H2O=H2CO3+OH-
+H2O=H2CO3+OH-
C.浓氢氧化钠溶液吸收少量SO2气体:SO2+2OH—=SO![]() +H2O
+H2O
 D.向小苏打溶液中加入醋酸溶液:HCO
D.向小苏打溶液中加入醋酸溶液:HCO![]() + H+ = CO2↑+ H2O
+ H+ = CO2↑+ H2O
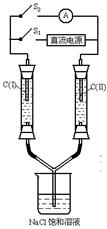
13.如右图所示装置,两玻璃管中盛满滴有酚酞溶液的NaCl饱和溶液,C(Ⅰ)、C(Ⅱ)为多孔石墨电极。接通S1后,C(Ⅰ)附近溶液变红,两玻璃管中有气体生成。一段时间后(两玻璃管中液面未脱离电极),断开S1,接通S2,电流表的指针发生偏转,说明此时该装置形成了原电池,关于该原电池的叙述正确的是
A. C(I)的电极名称是阴极
B.C(II)的电极名称是负极
C.C(I)的电极反应式是2H++2e—=H2↑
D.C(II)的电极反应式是Cl2+2e-=2Cl-
14. 将0.2mol·L-1HCOOH溶液和0.1mol·L-1的NaOH溶液等体积混合后,溶液显酸性,下列关系式中正确的是
A.c(HCOOH)<c(HCOO-) B.c(Na+)>c(HCOO-)
C.c(HCOOH)-c(HCOO-)=c(OH-) D.c(HCOOH)+c(HCOO-)=0.2mol·L-1
15.下列各组离子水溶液中能大量共存的是
A.I-、ClO-、NO3-、H+ B.Fe3+、Cu2+、SO42-、Cl-
C.H+、K+、AlO2-、HSO3- D.Ca2+、Na+、SO42-、CO32-
16.下表中实验操作能达到实验目的的是
| 实验操作 | 实验目的 | |
| A | 向甲酸钠溶液中加新制的Cu(OH)2并加热 | 确定甲酸钠中含有醛基 |
| B | 向苯酚的饱和溶液中滴加稀溴水 | 制备三溴苯酚 |
| C | 向酒精和醋酸的混合液中加入金属钠 | 确定酒精中混有醋酸 |
| D | 将溴乙烷与氢氧化钠溶液共热一段时间,再向冷却后的混合液中滴加硝酸银溶液 | 检验水解产物中的溴离子 |
三、(本题包括3小题,共21分)
17.(7分) A、B、C三种元素都是短周期元素,它们的原子核外电子层数相同。A、B元素各自形成的A离子和B离子均和Ne元素的原子电子层结构相同,A元素的氢氧化物比B元素的氢氧化物碱性强。5.8gB的氢氧化物恰好能与100mL 2mol/L盐酸完全反应。C元素的单质化学性质活泼但不能直接和氧气反应。根据上述条件,回答下列问题:
(1)A元素和C元素形成化合物的晶体类型是____▲____晶体。
(2)C元素在元素周期表中的位置是 ▲ ;C的最高价氧化物的分子式为 ▲ 。
(3)B的氢氧化物与盐酸反应的离子方程式: ▲ 。
(4)C元素的单质,可用A的最高价氧化物对应的水化物的溶液吸收,其离子方程式为 ▲ 。
18.(7分)某二元酸(H2A)在水中的电离方程式是:
H2A=H++HA-
HA-![]() H++A2-
H++A2-
回答下列问题:
⑴请判断H2A是强电解质还是弱电解质? ▲ ,理由是 ▲ 。
⑵已知0.1mol·L-1NaHA溶液的pH=2,则0.1mol·L-1 H2A溶液中氢离子的物质的量浓度应 ▲ 0.11 mol·L-1(填“<”,“>”或“=”),理由是: ▲
⑶Na2A溶液显 ▲ (填“酸性”,“中性”或“碱性”)。理由是 ▲ (用离子方程式表示)
⑷H2A溶液和Na2A溶液能否发生反应?能反应的写出离子方程式 ▲ 。
19.(7分)中学化学中几种常见物质的转化关系如下:
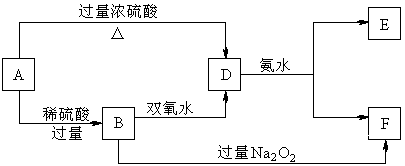
已知A→D的反应必须加热,否则会发生钝化现象。请回答下列问题:
(1)B、D、E的化学式依次为 ▲ 、 ▲ 、 ▲ 。
(2)写出B的酸性溶液与双氧水反应的离子方程式: ▲ 。
(3)写出B和过量过氧化钠反应生成F的化学方程式 ▲ 。
四、(本题包括2小题,共15分)
20.(5分)物质的分离是化学研究中常用的方法,填写下列物质分离时需使用的方法(不必叙述操作细节)。
(1)两种互不相溶的液体的分离 ▲ 。
(2)固体和液体的分离 ▲ 。
(3)含固体溶质的溶液中除去部分溶剂 ▲ 。
(4)胶体中分离出可溶电解质 ▲ 。
(5)几种沸点相差较大的互溶液体的分离 ▲ 。
21.(10分)已知多种重金属化合物能催化H2O2的分解。下图是氨的催化氧化的实验装置。试管中加入过量浓氨水并滴入2ml 5%AgNO3溶液;A为胶头滴管,预先吸有25%的H2O2溶液; B中装有铂石棉催化剂。点燃酒精灯一段时间后,将A中的H2O2溶液慢慢地滴入试管,试管内产生大量气体。不久,锥形瓶C内出现红棕色气体。回答下列问题:
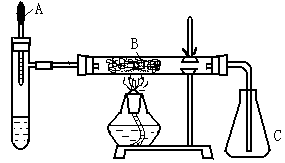
(1)你认为反应中能催化分解H2O2的物质是(写化学式) ▲ 。
(2)试管中产生的气体是 ▲ 。
(3)B中发生反应的化学方程式 ▲ 。
(4)本实验还可以改用其他药品,例如在试管中加固体 ▲ ,胶头
滴管预先吸入液体 ▲ 。
(5)除干燥装置外,此实验装置的缺点是还缺少 ▲ 装置。
五、(本题包括2小题,共12分)
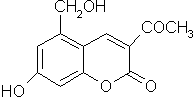 22.(6分)针对齐齐哈尔第二制药有限公司(以下简称齐二药)生产的假药“亮菌甲素注射液”导致多名患者肾功能衰竭一事,药品安全问题引起人们的关注。“亮菌甲素”结构简式如右图,是黄色或橙黄色结晶粉末,几乎不溶于水,辅料丙二醇(C3H8O2)溶成针剂用于临床。该药为利胆解痉药,适用于急性胆囊炎、慢性胆囊炎急性发作及慢性浅表性胃炎等。
22.(6分)针对齐齐哈尔第二制药有限公司(以下简称齐二药)生产的假药“亮菌甲素注射液”导致多名患者肾功能衰竭一事,药品安全问题引起人们的关注。“亮菌甲素”结构简式如右图,是黄色或橙黄色结晶粉末,几乎不溶于水,辅料丙二醇(C3H8O2)溶成针剂用于临床。该药为利胆解痉药,适用于急性胆囊炎、慢性胆囊炎急性发作及慢性浅表性胃炎等。
(1) 写出“亮菌甲素”的分子式 ▲ 。
(2) 1 mol亮菌甲素最多能和 ▲ mol H2发生反应,该反应类型是 ▲ 反应。
(3) 写出“亮菌甲素”和足量NaOH溶液完全反应的化学反应方程式:
▲ 。
23.(6分)含碳、氢、氧元素的下列有机物分子式通式:
A.![]() B.
B.![]() C.
C.![]()
D.![]() E.
E.![]() F.
F.![]()
(1)若充分燃烧某类有机物,消耗氧气的体积与生成二氧化碳的体积之比为5∶4(相同条件下),则该类有机物分子式通式是上述各式中的 ▲ (填代号)。
(2)若某有机物分子式符合上述C的通式,其相对分子质量为136,写出该有机物的分子式 ▲ ;若该有机物属于酯类且分子中含有苯环.则其可能的同分异构体有 ▲ _种,写出其中不能发生银镜反应的同分异构体的结构简式 ▲ 。
六、(本题包括2小题,共12分)
24.(6分)在一定温度下有甲、乙两容积相等的容器。
(1)向甲容器中通入3 mol N2和4 mol H2,反应达到平衡时,生成NH3 a mol。此时,NH3的物质的量分数是 ▲ 。若在达到平衡状态的甲容器中通入少量的N2,则达到新平衡时,体系中N2的体积分数将 ▲ (选填“增大”、“减小”若“不变”)。
(2)向乙中通入2 mol NH3,欲使反应达到平衡时,各物质的浓度与(1)中第一次平衡时相同,则起始时还需通入 ▲ molN2和 ▲ molH2。
(3)若起始时,向乙中通入6molN2和8molH2,达到平衡时,生成的NH3的物质的量为b mol,则![]() ▲
▲ ![]() (选填“>”、“<”或“=”)。
(选填“>”、“<”或“=”)。
25.(6分)将5.1 g镁铝合金溶于600 mL 0.5 mol·L-1H![]() SO
SO![]() 溶液中,完全溶解后再加入1.0 mol·L-1的NaOH溶液,得到沉淀的质量为13.6 g,继续滴加NaOH溶液时则沉淀会减少。
溶液中,完全溶解后再加入1.0 mol·L-1的NaOH溶液,得到沉淀的质量为13.6 g,继续滴加NaOH溶液时则沉淀会减少。
(1)当加入___▲__mLNaOH溶液时,可使溶解在硫酸中的Mg![]() 和Al
和Al![]() 恰好完全沉淀。
恰好完全沉淀。
(2)计算合金溶于硫酸时所产生的氢气在标准状况下的体积。(列出算式)