上学期期末测试题
(100分钟100分)
第Ⅰ卷(选择题,共40分)
一、选择题(每小题只有一个选项符合题意,每小题2分,共22分)
1.方志敏烈士生前在狱中曾用米汤(内含淀粉)给鲁迅先生写信,鲁迅先生收到信后为了看清信中的内容,使用的化学试剂是…………………………………………………( B )
A.碘化钾 B.碘酒 C.溴水 D.碘化钾淀粉试液
2.下列物质属于纯净物的是……………………………………………………………( B )
A.漂粉精 B.液氯 C.氯水 D.浓盐酸
3.下列离子中,所含氯元素不能被氧化的是…………………………………………( D )
A.Cl— B.ClO— C.ClO3— D.ClO4—
4.下列叙述正确的是……………………………………………………………………( B )
A.NaCl的摩尔质量是58.5 g B.等质量的H2SO4 和H3PO4所含的分子数相等
C.等质量的CO2 和NO2 所含的氧原子数相等
D.将98 g H2SO4溶解于1L水中,所得溶液中H2SO4的物质的量浓度为1 mol·L—1
5.下列物质中,含有分子数最多的是…………………………………………………( D )
A.22.4 L H2 (标准状况) B.3.01×1023个Cl2
C.9 g H2O D.600mL 2 mol·L—1蔗糖溶液中的溶质
6.在标准状况下,与4 g H2的体积相等的O2的……………………………………( C )
A.质量为4 g B.物质的量为4mol C.物质的量为2mol D.质量为128g
7.设NA代表阿伏加德罗常数的值,下列说法正确的是……………………………( A )
A.2.3 g Na变成Na+时,失去的电子数为0.1NA
B.11.2 L O2中所含的原子数为NA C.28 g N2 所含的原子数为NA
D.标准状况下,2.24 L H2O所含的分子数为0.1NA
8.下列溶液中,Cl—浓度最小的是……………………………………………………( B )
A.1 L 0.2 mol·L—1 KCl溶液 B.0.2 L 0.1 mol·L—1HCl溶液
C.0.1 L 0.1 mol·L—1 AlCl3溶液 D.0.15 L 0.1 mol·L—1MgCl2溶液
9.水在下列反应中表现出还原性的是…………………………………………………( B )
A.2K + 2H2O =2KOH +H2↑ B.2F2 +2H2O = 4HF + O2
C.2Na2O2 + 2H2O =4NaOH + O2↑ D.CaO + H2O = Ca(OH)2
10.下列各组离子中,能在溶液中大量共存的是……………………………………( A )
A.Ba2+、OH—、Na+、NO3— B.Ag+、NO3—、Br—、H+
C.HCO3-、Na+、H+、K+ D.Ba2+、K+、SO42-、Na+
11.下列物质中的杂质(括号内为杂质)可以加热除去的是……………………………( C )
①KClO3 (MnO2 ) ②NaCl(KI) ③KI(I2 ) ④Na2CO3 (NaHCO3 )
A.①③ B.①③④ C.③④ D.①②③④
二、选择题(每小题只有一个选项符合题意,每小题3分,共18分)
12.下列有关物质的性质比较中,正确的是…………………………………………( A )
A.稳定性HF>HCl>HBr>HI B.原子半径F>Cl>Br>I
C.氧化性I2 >Br2 >Cl2 >F2 D.熔点F2 >Cl2 >Br2 >I2
13.下列离子方程式书写正确的是……………………………………………………( C )
A.碳酸氢钠溶液与稀硫酸反应 CO32- + 2H+=H2O +CO2 ↑
B.碳酸银与稀硝酸反应 CO32- + 2H+=H2O +CO2 ↑
C.硫酸与氢氧化钡溶液反应 2H+ + SO42- + Ba2+ +2OH—=BaSO4↓+ 2H2O
D.金属钠与水反应Na + 2H2O =Na+ + 2OH—+H2↑
14.已知砹(At)属于卤族元素。下列关于砹及其化合物的叙述中正确的是…………( A )
A.用KAt的水溶液制备砹的化学方程式为:2KAt + Cl2 =2KCl + At2
B.AgAt是一种可溶于水的砹化物 C.相同条件下,HAt比HI更稳定
D.At在常温下呈气态
15.在同温同压下,有相同质量的气体X和Y,已知Y的体积大于X,则它们的摩尔质量之间的关系是…………………………………………………………………………( B )
A.M(X)<M(Y) B.M(X)>M(Y) C.M(X)=M(Y) D.无法确定
16.有一种碘和氧的化合物可以称为碘酸碘,其中碘元素呈+3、+5两种价态,则这种化合物的化学式为………………………………………………………………………( D )
A.I2O4 B.I3O5 C.I4O7 D.I4O9
17.质量为a g的NaOH固体(密度为b g·cm—3 )溶于体积为c mL的水(密度为1
g·cm—3 )中,得到密度为d g·cm—3 的NaOH溶液,则该溶液中NaOH的物质的量浓度为……………………………………………………………………………………( B )
A.![]()
![]() B.
B.![]() C.
C.![]() D.
D.![]()
第Ⅱ卷(非选择题,共60分)
三、填空题(共33分)
18.(9分)卤族元素原子的最外电子层上都有 7 个电子,跟金属反应时容易得到 1 个电子,因此都具有较强的(填“氧化”还原”) 氧化 性,其中非金属性最强的元素是
F 。卤素单质中,与氢气混合后在冷暗处就能发生剧烈反应的是(填化学式) F2 。碱金属元素的原子最外电子层上都只有 1 个电子,在化学反应中容易 失去 电子,因此都可作 还原 剂。碱金属元素(钫除外)中金属性最强的是(填元素名称) 铯 。
19.(8分)配制500mL 0.2 mol·L—1Na2CO3溶液时,需用天平称取 10.6 g无水碳酸钠固体。将其放入烧杯中,用适量的蒸馏水溶解,待 冷却至室温 后,将烧杯中的溶液沿 玻璃棒 小心地注入 500mL的容量瓶 中。然后 用蒸馏水洗涤烧杯和玻璃棒2~3次 ,并将 洗涤液全部转移到容量瓶中 ,轻轻振荡,使溶液混合均匀,然后再缓缓注入蒸馏水,直到 液面接近到距刻度线1cm~2cm 时,改用 胶头滴管 滴加蒸馏水到刻度。这时,盖好瓶盖,反复上下颠倒摇匀。
20.(10分)根据下列图示(反应生成的水已略去)推断:
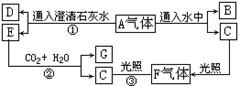 (1)写出图示中下列物质的化学式:
(1)写出图示中下列物质的化学式:
A Cl2 ,C HClO ,E Ca(ClO)2 ,
G CaCO3 [或Ca(HCO3)2] 。
(2)写出图中①②③步反应的化学方程式:
① 2Cl2 + 2Ca(OH)2 =CaCl2 + Ca(ClO)2 + 2H2O 。
②Ca(ClO)2 + H2O + CO2 = CaCO3↓+2HClO 或 Ca(ClO)2+2H2O+2CO2 = Ca(HCO3)2↓+ 2HClO 。
③ 2HClO ![]() 2HCl + O2 。
2HCl + O2 。
21.(3分)19g某二价金属氯化物(ACl2 )中含0.4mol Cl—,该氯化物的摩尔质量是 95 g·mol—1 ,它的相对分子质量为 95 ,A的相对原子质量是 24 。
22.(3分)在100℃、0.5×105Pa下,有H2O和NH3两种气体。
(1)若体积相同,则二者的分子个数比为 1∶1 ,密度比为 18∶17 。
(2)当二者氢原子数相等时,它们的体积之比是 3∶2 。
四、实验题(共19分)
23.(13分)实验室用下列装置先制取干燥、纯净的Cl2,然后进行有关性质实验,试根据下列装置回答问题:
(1)按气体从左到右流向,上述各装置的连接顺序为(以图中字母A~G表示):A→ E→ F → C → D → B → G
(2)A装置的反应中氧化剂是 MnO2 ,还原剂是 浓HCl (均填化学式),制得的Cl2 中所含的杂质气体为 HCl和水蒸气 ;E装置的作用是 除HCl ;D装置中的现象为 布条褪色 ;反应结束后,振荡B装置,静置后出现的现象是下层液为紫红色 。
(3)写出下列装置中反应的离子方程式:
①B装置中: Cl2 + 2I— =I 2 + 2Cl— 。
②G装置中:Cl2 + 2OH—=Cl— + ClO— + H2O 。
24.(6分)某固体混合物可能由KNO3、K2SO4、KI、NaCl、CuCl2、CaCl2和Na2CO3中的一种或几种组成。依次进行下列五步实验,观察到的现象记录如下:
①取一定量混合物加水溶解得无色透明溶液:
②向上述溶液中滴加BaCl2溶液,有白色沉淀生成,将该沉淀滤出,并将滤液分成两份:
③上述白色沉淀可完全溶解于稀盐酸中:
④往一份滤液中滴加氯水后振荡,溶液颜色无明显变化;
⑤往另一份滤液中加入AgNO3溶液,有白色沉淀生成,该沉淀不溶于稀硝酸。
根据以上实验现象,可以判断出混合物中肯定含有 Na2CO3 ;肯定不含有的物质是 CuCl2 、K2SO4 、CaCl2、KI ;不能判断混合物中是否含有的物质是 KNO3 、NaCl
五、计算题(共8分)
25.(4分)将一定体积的密度为1.19 g·cm—3 、HCl的质量分数为36.5%的浓盐酸稀释至100mL时,溶液中的Cl—浓度为1.02 mol·L—1。计算所用浓盐酸的体积。
答案:8.57ml。
26.(4分)某软锰矿石中MnO2 的质量分数为87%,如果其他成分不与浓盐酸反应,则150 g此矿石与足量浓盐酸反应,制得的氯气在标准状况下的体积是多少?
答案:33.61